
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| y |
| 2 |
| x |
| 2 |
| y |
| 2 |
| x |
| 2 |
| y |
| 2 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:北京市东城区2006-2007年学年度高三第一学期期末教学目标检测、化学 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应2SO2(g)+O2(g) ![]() 2SO3(g);
2SO3(g);
(1)500℃时,将a molSO2与b molO2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b= mol。
②反应进行至10min时,测得反应放热392kJ,则上述热化学方程式中的
△H= kJ/mol。
③10min内平均速率n(SO2)= mol/(L?min)。
④反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时
c(SO3)= mol/L,SO2的转化率a1(SO2)= 。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率a2与(1)SO2的转化率a2的关系是:a2 a1(填=、>或<)
查看答案和解析>>
科目:高中化学 来源:0103 月考题 题型:填空题
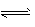 2SO3(g);正反应放热。
2SO3(g);正反应放热。 查看答案和解析>>
科目:高中化学 来源:湖北省期末题 题型:填空题
将4mol SO3气和4mol NO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 2NO2?
2NO2?
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1mol、n(NO2)=3.6mol,则此时
SO3气的物质的量为____________。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和____________,或NO和____________(填它们的分子式)。
(3)若在另外一个2L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是
2NO2,其中NO、O2、NO2的起始浓度依次是
0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是________(填字母代号) 。
A.c(NO)=0.35 mol/L或c(NO)=0.09 mol/L
B.c(NO2)=0.4 mol/L
C.c(NO2)=0.35 mol/L
D.c (O2)=0.2 mol/L或c(NO)=0.4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com