
 2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)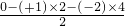 =+3,
=+3, 2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,则KClO3为氧化剂,
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,则KClO3为氧化剂,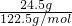 =0.2mol,反应中Cl元素的化合价由+5价降低为+4价,则转移的电子数为0.2×(5-4)×NA=0.2NA,故答案为:0.2NA;
=0.2mol,反应中Cl元素的化合价由+5价降低为+4价,则转移的电子数为0.2×(5-4)×NA=0.2NA,故答案为:0.2NA;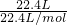 =1mol,由反应可知,生成等物质的量的两种气体,则CO2的物质的量为0.5mol,由H2C2O4~2CO2,则参加反应的
=1mol,由反应可知,生成等物质的量的两种气体,则CO2的物质的量为0.5mol,由H2C2O4~2CO2,则参加反应的 计算KClO3的物质的量,再利用化合价变化来计算转移的电子数;
计算KClO3的物质的量,再利用化合价变化来计算转移的电子数;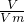 计算气体的物质的量,二氧化碳的物质的量为收集到气体的物质的量的一半,再利用化学反应方程式来分析计算.
计算气体的物质的量,二氧化碳的物质的量为收集到气体的物质的量的一半,再利用化学反应方程式来分析计算.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省淄博市高一(上)期中化学试卷(解析版) 题型:解答题
 2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)
2ClO2↑+K2SO4+2CO2↑+2H2O(说明:H2C2O4中氢元素化合价为+1,氧元素化合价为-2)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com