
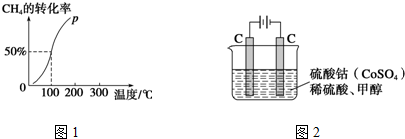
分析 (1)根据热化学方程式和盖斯定律计算书写;
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,根据c=$\frac{△n}{\frac{V}{△t}}$计算v(H2);
(3)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
①甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+;
②负极上燃料失电子发生氧化反应,注意电解质溶液是碱性溶液;
③依据化学方程式计算消耗氢氧化钾物质的量.
解答 解:(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2 H2(g)=CH3OH(g)△H=-129.0 kJ/mol
将方程式①+②得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol+(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{1.5mol}{\frac{100L}{5min}}$=0.003 mol•L-1•min-1,
故答案为:0.003;
(3)①甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
故答案为:6;CO2↑;6;6H+;
②正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+H2O+4e-═4OH-,负极是甲醇失电子在碱性溶液中生成碳酸钾,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
③依据化学方程式计算分析2CH3OH+3O2+4KOH→2K2CO3+6H2O,净化含1mol甲醇的水燃料电池需消耗KOH物质的量2mol;
故答案为:2.
点评 本题考查热化学方程式书写、反应速率计算、原电池等,注意盖斯定律书写热化学方程式应用,注意电极反应式要结合电解质溶液酸碱性书写,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤ | C. | ①②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
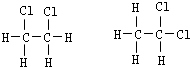 E、
E、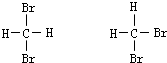
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 贮存能量 | |
| D. | 断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com