
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的过程如下:
(1)以氮气、氢气为原料合成氨①下列措施可以提高H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ![]() ,则N2的转化率a1=;
,则N2的转化率a1=;
若容器压强恒定,达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”)
(2)以氨气、空气为主要原料制硝酸.在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) . 
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸厂常用如下2种方法处理尾气.①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 .
【答案】
(1)bc;12.5%;>
(2)ad
(3)4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1034.7kJ/mol
【解析】解:(1)①a.选择适当的催化剂,不会引起化学平衡的移动,故错误; b.增大压强,可以促使化学平衡正向移动,可以提高H2的转化率,故正确;c.及时分离生成的NH3 , 可以促使化学平衡正向移动,可以提高H2的转化率,故正确; d.升高温度会使得化学平衡逆向移动,降低反应物的转化率,故D错误;故选:bc.②一定温度下,在1L密闭容器中充入1mol N2和3molH2并发生反应.若容器容积恒定,达到平衡时,气体的总压强为原来的 ![]() ,依据化学平衡三段式列式计算,设氮气消耗物质的量为x; N2+3H2=2NH3
,依据化学平衡三段式列式计算,设氮气消耗物质的量为x; N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1﹣x 3﹣3x 2x![]() =
= ![]() ,解得:x=0.125mol
,解得:x=0.125mol
则N2的转化率α(N2)= ![]() ×100%=12.5%;随着反应的进行,气体的物质的量减小,所以压强减小,保持恒压,则相当于在恒容的基础上加压,正向移动建立新平衡,所以反应物的转化率增加,即a2>a1 , 所以答案是:12.5%;>;(2)a.反应是前后系数和变化的反应,可依据容器内气体的压强保持不变判断反应已达到平衡状态,故正确; b.在t2时,正逆反应速率加快,平衡正向移动,采取的措施可以是升高温度,还可以是加压,故错误; c.容器内气体的密度等于气体质量和体积的比值,始终是保持不变的量,所以密度不变的时候反应不一定达到平衡状态,故错误; d.根据影响因素引起的都是平衡正向移动,所以容器内NO2的体积分数始终是减小的,即在t3时容器内NO2的体积分数在t3时值的最大,故正确.故选:ad;(3)已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=﹣483.5kJ/molⅡ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol由盖斯定律可知,Ⅰ×2﹣Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),故△H=2×(﹣483.5kJ/mol)﹣67.7kJ/mol=﹣1100kJ/mol,故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1034.7kJ/mol,所以答案是:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1034.7kJ/mol.
×100%=12.5%;随着反应的进行,气体的物质的量减小,所以压强减小,保持恒压,则相当于在恒容的基础上加压,正向移动建立新平衡,所以反应物的转化率增加,即a2>a1 , 所以答案是:12.5%;>;(2)a.反应是前后系数和变化的反应,可依据容器内气体的压强保持不变判断反应已达到平衡状态,故正确; b.在t2时,正逆反应速率加快,平衡正向移动,采取的措施可以是升高温度,还可以是加压,故错误; c.容器内气体的密度等于气体质量和体积的比值,始终是保持不变的量,所以密度不变的时候反应不一定达到平衡状态,故错误; d.根据影响因素引起的都是平衡正向移动,所以容器内NO2的体积分数始终是减小的,即在t3时容器内NO2的体积分数在t3时值的最大,故正确.故选:ad;(3)已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=﹣483.5kJ/molⅡ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol由盖斯定律可知,Ⅰ×2﹣Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),故△H=2×(﹣483.5kJ/mol)﹣67.7kJ/mol=﹣1100kJ/mol,故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1034.7kJ/mol,所以答案是:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1034.7kJ/mol.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( ) 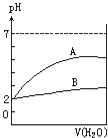
A.酸B比酸A的电离度大
B.A为弱酸,B为强酸
C.酸B的物质的量浓度比A的小
D.A酸比B酸易电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A.有5.6 g金属被腐蚀
B.有6.5 g金属被氧化
C.有0.15 mol金属失去电子
D.标准状况下有4.48 L H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17∶40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y 的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X____________、Y____________、Z____________。
(2)X与Y形成的离子化合物的电子式为 ______________ 。
(3)Y 元素在周期表中的位置为__________,其单质在空气中燃烧产物的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有CuSO4、NaCl、KNO3各1mol的溶液分别置于甲、乙、丙三个烧杯中进行电解(电极均为石墨且质量相等),如图1所示.接通电源一段时间后,b电极质量增加;常温下,三个烧杯中溶液的pH随通电时间的变化如图2.
(1)M是直流电源的极;(填“正”或“负”)
(2)乙烧杯内若滴入酚酞试液,则在极区域先出现红色;(填“c”或“d”)
(3)0~t1秒内,e电极上生成的气体在标准状况下的体积为L,t1秒时,电极b、c的质量差为g;
(4)t2秒时,若将直流电源正、负极对调,则电解至各电极质量均不再发生变化的过程中,a电极涉及到的电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是 ( )
A. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B. 过滤除去氯化钠溶液中的泥沙
C. 食品加工厂利用豆浆中加入盐卤做豆腐
D. 化工厂利用静电除尘技术去除废气中的固体悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示装置的叙述不正确的是( ) 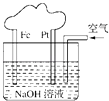
A.这是一个原电池装置
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e﹣═4OH﹣
C.该装置中Fe为负极,电极反应为:Fe﹣2e﹣+2OH﹣═Fe(OH)2
D.这是电解NaOH溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简答题:
(1)NH4Cl溶液呈 , 用离子方程式表示原因 .
(2)普通泡沫灭火器的钢铁容器里装着一只小玻璃筒,其中玻璃筒内盛装溶液,使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫.产生此现象的离子方程式是 .
(3)NaHSO3溶液呈性,原因 .
(4)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com