
【题目】某化学兴趣小组用稀硫酸和高纯度锌粒按如图所示装置制取H2并还原CuO时,发现尾气略有刺激性。通过进一步探究,证明尾气中含有SO2。
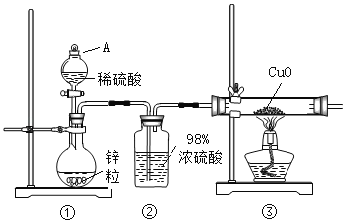
(1)A装置的名称_____;②装置中浓硫酸的作用_____;
(2)经讨论,认为SO2的产生有以下两种可能:
甲同学:_____反应产生了SO2;
乙同学:H2与②装置中浓硫酸反应产生了SO2;
请完善甲同学的猜想,并结合供选试剂设计简单方案求证乙同学猜想的合理性。(仪器任选;除上述试剂外,可另选试剂如下:稀盐酸、稀硝酸、无水氯化钙、碱石灰)________________________
(3)如果乙同学猜想成立,请用化学方程式表示其原理_____;
(4)已知常温下H2不能与酸性高锰酸钾溶液反应,有同学提出可以在②装置前用酸性高锰酸钾溶液除去SO2,请用离子方程式表示反应的原理:_____;
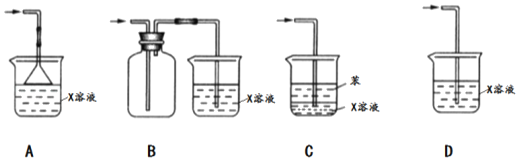
(5)SO2是一种有毒的污染性气体,实验室常用X溶液进行尾气处理,X是_____(填化学式);尾气吸收时下列装置不能起到防倒吸效果的是_____(填选项)。
【答案】分液漏斗 干燥 锌粒与硫酸
方案一 | A中用稀盐酸代替稀硫酸 | 若收集到的气体依然含有二氧化硫 | 乙的猜想正确 |
方案二 | ②装置中用装无水氯化钙的球形干燥管代替浓硫酸 | 若收集到的气体不含二氧化硫 | 乙的猜想正确 |
H2+H2SO4(浓)=SO2+2 H2O 5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn 2++4H+ NaOH BCD
【解析】
(1)根据装置图确定仪器的名称;浓硫酸具有吸水性,常用作干燥剂;
(2)二氧化硫的产生可能是锌粒与硫酸反应生成的,也可能是H2与②装置中浓硫酸反应产生了SO2,据此两位同学进行猜想;
(3)氢气与浓硫酸反应,生成SO2和水;
(4)高锰酸钾具有强氧化性,可将SO2氧化为SO42-,自身被还原为Mn2+;
(5)SO2为酸性气体,用碱液进行尾气吸收。
(1)由装置图可知,A为分液漏斗;②浓硫酸吸收随氢气出来的水份,起干燥的作用;
故答案为:分液漏斗;干燥;
(2)二氧化硫的产生可能是锌粒与硫酸反应生成的,也可能是H2与②装置中浓硫酸反应产生了SO2,所以甲同学的猜测为锌粒与硫酸反应;方案一:A中用稀盐酸代替稀硫酸,若收集到的气体依然含SO2则乙猜想正确;方案二:②装置中用装无水氯化钙的球形干燥管代替浓硫酸,若收集到的气体不含SO2则乙猜想正确;
方案一 | A中用稀盐酸代替稀硫酸 | 若收集到的气体依然含有二氧化硫 | 乙的猜想正确 |
方案二 | ②装置中用装无水氯化钙的球形干燥管代替浓硫酸 | 若收集到的气体不含二氧化硫 | 乙的猜想正确 |
(3)如果乙同学猜想成立,则氢气与浓硫酸反应生成二氧化硫与水,方程式为:H2+H2SO4(浓)=SO2+2 H2O;
(4)酸性高锰酸钾与二氧化硫发生氧化还原反应,得到硫酸根离子和二价锰离子,其离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn 2++4H+;
(5)二氧化硫是有毒性气体,必须进行尾气的处理,常用碱液来吸收,故用氢氧化钠溶液,尾气吸收时装置要防倒吸,A中漏斗可以防止倒吸,BCD均插入在溶液中,溶液易倒吸。


科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )
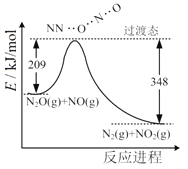
A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 为原料进行实验,装置如下图所示。
为原料进行实验,装置如下图所示。

⑴装置![]() 烧瓶中发生反应的化学方程式为:_________________________________。
烧瓶中发生反应的化学方程式为:_________________________________。
⑵装置![]() 、
、![]() 中应盛放的试剂名称分别为__________、_________;从
中应盛放的试剂名称分别为__________、_________;从![]() 装置导出的气体若不经过
装置导出的气体若不经过![]() 、
、![]() 装置而直接进入
装置而直接进入![]() 管,将对实验产生的不良后果是___________________________。
管,将对实验产生的不良后果是___________________________。
⑶实验时,先点燃![]() 处的酒精灯,让氯气充满装置,再点燃
处的酒精灯,让氯气充满装置,再点燃![]() 处酒精灯,写出
处酒精灯,写出![]() 中反应的化学方程式:_________________________________________。
中反应的化学方程式:_________________________________________。
⑷![]() 装置所起的作用是____________________,____________________。
装置所起的作用是____________________,____________________。
⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 经粉碎的硫黄燃烧得较快、较完全
B. 实验室可以用饱和食盐水收集氯气
C. 合成NH3反应为放热反应,为提高NH3的产率,应采取升高温度的措施
D. 对H2、I2、HI平衡体系加压混和气体后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
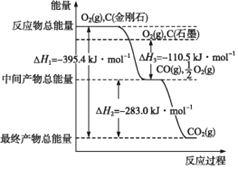
①在通常状况下,金刚石和石墨中____![]() 填“金刚石”或“石墨”
填“金刚石”或“石墨”![]() 更稳定,石墨的燃烧热为____。
更稳定,石墨的燃烧热为____。
②1mol金刚石不完全燃烧生成CO时放出的热量为____。
(2)50mL0.5molL-1的盐酸与50mL0.55molL-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会___;用NaOH固体进行上述实验,测得的中和热会___![]() 均填“偏大”“偏小”“无影响”
均填“偏大”“偏小”“无影响”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要____(填“放出”或“吸收”)___kJ的热量。
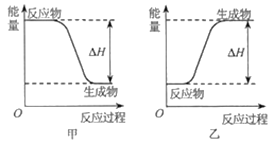
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图____(填“甲”或“乙”)。
(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的H___(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积,不同浓度的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液中Cl-的物质的量浓度之比是
A.1:2:3B.3:2:1C.6:3:2D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
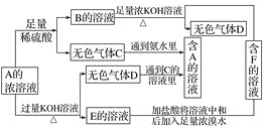
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com