
 )$\stackrel{一定条件}{→}$PMAA
)$\stackrel{一定条件}{→}$PMAA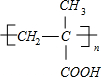 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O .
. 分析 采取逆推法,抓住碳链骨架及官能团的变化及性质,并根据反应条件判断反应类型和相关物质,PMAA就是一种高分子,合成PMAA的路线可知,CH2=C(CH3)-COOH→PMAA,应发生加聚反应,故PMAA为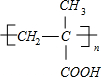 ,由E→F的反应条件可知,该反应是醇的消去反应,故E中含有-OH、-COOH,由C→D→E反应,都是与氧气在催化剂加热的条件下反应,应为醇→醛→羧酸,且有1个-OH不能被氧化,故E为
,由E→F的反应条件可知,该反应是醇的消去反应,故E中含有-OH、-COOH,由C→D→E反应,都是与氧气在催化剂加热的条件下反应,应为醇→醛→羧酸,且有1个-OH不能被氧化,故E为 ,D为
,D为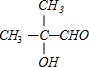 ,C为
,C为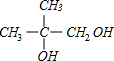 ,由B→C反应在氢氧化钠水溶液、加热条件下,可知为卤代烃的水解,B为
,由B→C反应在氢氧化钠水溶液、加热条件下,可知为卤代烃的水解,B为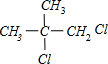 ,结合A→B可知,为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
,结合A→B可知,为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
解答 解:PMAA就是一种高分子,合成PMAA的路线可知,CH2=C(CH3)-COOH→PMAA,应发生加聚反应,故PMAA为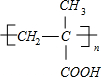 ,由E→F的反应条件可知,该反应是醇的消去反应,故E中含有-OH、-COOH,由C→D→E反应,都是与氧气在催化剂加热的条件下反应,应为醇→醛→羧酸,且有1个-OH不能被氧化,故E为
,由E→F的反应条件可知,该反应是醇的消去反应,故E中含有-OH、-COOH,由C→D→E反应,都是与氧气在催化剂加热的条件下反应,应为醇→醛→羧酸,且有1个-OH不能被氧化,故E为 ,D为
,D为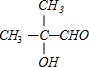 ,C为
,C为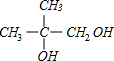 ,由B→C反应在氢氧化钠水溶液、加热条件下,可知为卤代烃的水解,B为
,由B→C反应在氢氧化钠水溶液、加热条件下,可知为卤代烃的水解,B为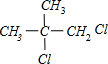 ,结合A→B可知,为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
,结合A→B可知,为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
(1)通过以上分析知,A和PMAA结构简式分别为:A为CH2=C(CH3)-CH3,PMAA为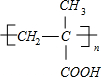 ,
,
故答案为:CH2=C(CH3)-CH3;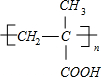 ;
;
(2)D为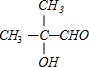 ,含有羟基和醛基两种官能团,故答案为:羟基、醛基;
,含有羟基和醛基两种官能团,故答案为:羟基、醛基;
(3)通过以上分析知,②、③反应类型分别是取代反应和消去反应,
故答案为:取代反应;消去反应;
(4)E为 ,F为CH2=C(CH3)-COOH,在浓硫酸作催化剂、加热条件下,E发生消去反应生成F,反应方程式为:
,F为CH2=C(CH3)-COOH,在浓硫酸作催化剂、加热条件下,E发生消去反应生成F,反应方程式为: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
故答案为: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
(5)E在有浓硫酸和加热的条件下,还可能生成一种环状产物,其结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意有机推断是高考中的一个重要题型,每年高考中必考,需熟悉有机化合物知识,结合题目中的信息要求来加以应用,能较好的考查考生的阅读、自学能力和思维能力,是高考热点题型,难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:填空题
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
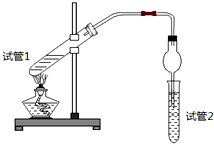 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH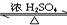 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 双鸭山市第一中学高二化学兴趣小组设计的苯和液溴反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
双鸭山市第一中学高二化学兴趣小组设计的苯和液溴反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.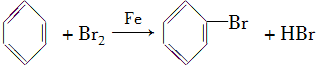 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的最外层电子数都等于它的最高正化合价 | |
| B. | 同一主族的元素的原子最外层电子数相等 | |
| C. | 同周期的主族元素随核电荷数的递增原子半径逐渐减小 | |
| D. | 第N周期有N种主族元素是金属元素(N>1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | <0.45mol | B. | 0.45mol | ||
| C. | 0.45-0.90mol之间 | D. | >0.90mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体、溶液、浊液的分类依据是分散质微粒直径大小 | |
| B. | “卤水点豆腐”、“黄河入海口处的沙洲”都与胶体的聚沉有关 | |
| C. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 | |
| D. | 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某无色溶液中:Al3+、Cu2+、SO42-、Cl- | |
| B. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Fe2+、K+、Cl-、NO3- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Na+、Mg2+、NO3-、Cl- | |
| D. | 含有大量HCO3-的溶液中:NH4+、Al3+、Ca2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com