
| A. | 溶融氢氧化钾 | B. | 液态氯化氢 | C. | 氯化镁晶体 | D. | 氯化钠溶液 |
分析 能导电的物质必须含有自由电子或自由移动的离子;电解质是指:在水溶液中或熔融状态下能够导电的化合物;电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
单质、混合物,不是电解质,据此分析即可解答.
解答 解:A、熔融的KOH能导电,且是电解质,故A正确;
B、液态的HCl不能导电,但是电解质,故B错误;
C、氯化镁晶体不能导电,但是电解质,故C错误;
D、氯化钠溶液能导电,但不是电解质,故D错误.
故选A.
点评 本题考查了导电的物质和电解质概念的判断,抓住“能导电的物质必须含有自由电子或自由移动的离子;电解质是化合物在水溶液中或熔融状态下,能电离”,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:多选题
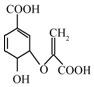
| A. | 分子式为C9H10O6 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 可使溴的四氧化碳溶液,酸性高锰酸钾溶液褪色,且原理相同 | |
| D. | 分子中含有三种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | Ca(OH)2+SO2═CaSO3+H2O | |
| D. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | |
| B. | pH<7的溶液 | |
| C. | c(OH-)<c(H+)的溶液 | |
| D. | 25℃时,由水电离出来的c(H+)=1×10-9mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液与过量氨水的反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氯水与碘化钾溶液的反应:Cl2+2I-═2Cl-+I2 | |
| C. | 铁粉与足量稀硫酸的反应:2Fe+3H+═2Fe3++3H2↑ | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1的NaOH溶液:K+、Ba2+、Cl-、NO3- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、NO3-、Cl- | |
| D. | 0.1mol•L-1的HCl溶液:K+、Na2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com