
【题目】高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:
(1)配平下列化学方程式,并标明电子转移的方向与数目:
________Fe(OH)3+________NaOH+________NaClO→________Na2FeO4+________NaCl+________H2O,___________
(2)该反应中还原产物是________(填写化学式),________元素被氧化,氧化剂的电子式为________。
(3)当反应中有1mol Na2FeO4生成,转移的电子有________mol.
(4)如果配制250mL 0.1mol/L NaOH溶液,需要称取________g NaOH固体,所需的仪器有玻璃棒、胶头滴管、烧杯、________、________。
【答案】2;4;3;2;3;5;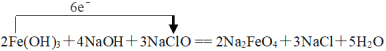
![]() Fe
Fe ![]() 3 1.0 托盘天平 250mL容量瓶
3 1.0 托盘天平 250mL容量瓶
【解析】
⑴反应中Fe(OH)3 → Na2FeO4,Fe元素化合价由+3价升高为+6价。升高3价,NaClO → NaCl,Cl元素的化合价由+1价降低为-1价,降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,NaClO系数为3,由Fe元素守恒故Na2FeO4系数为2,由Cl元素守恒NaCl系数为3,由Na元素守恒NaOH系数为4,由H元素守恒H2O系数为5,配平后方程式为:2Fe(OH)3+4NaOH+3NaClO == 2Na2FeO4+3NaCl+5H2O,电子转移为: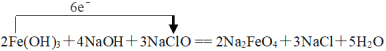 ,故答案为:2;4;3;2;3;5;
,故答案为:2;4;3;2;3;5;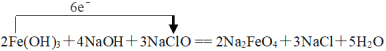 ;
;
⑵该反应中氧化剂是次氯酸钠,铁元素化合价升高,被氧化,次氯酸钠被还原对应还原产物为氯化钠,氯化钠为离子化合物,故答案分别为NaCl;Fe;![]() ;
;
⑶根据方程式元素化合价变化可以知道,反应有2 mol Na2FeO4生成,转移6 mol 电子,则生成1 mol Na2FeO4,转移3 mol电子;故答案为3;
⑷如果配制250mL 0.1mol/L NaOH溶液,需要称取氢氧化钠质量为:![]() ,
,
用到的仪器:托盘天平、钥匙、烧杯、玻璃棒、250 mL容量瓶、胶头滴管,所以需要定量仪器:托盘天平、250 mL容量瓶;故答案为1.0;托盘天平;250 mL容量瓶。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
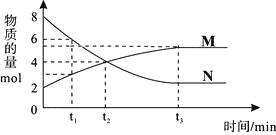
A. 反应的化学方程式为:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出a mol气体,同时有wg Na2SO410H2O晶体析出,若温度不变,剩余溶液的溶质的质量分数为
A. ![]() ×100% B.
×100% B. ![]() ×100%
×100%
C. ![]() % D.
% D. ![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液。K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO2并探究其性质。
(一)K2FeO4的制备
该小组用下图所示装置制备K2FeO4(夹持装置略)。

(1)以上装置图中有一处明显的错误请你帮助指出来:___________。B中应盛装的试剂是___________。
(2)写出A中发生反应的离子方程式:___________。
(3)C中发生的反应有Cl2+2OH-=Cl-+ClO-+H2O,还有生成K2FeO4的反应。写出得到紫色固体K2FeO4的化学方程式:___________。
(二)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4。
(4)絮凝实验:甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请结合方程式,说明K2FeO2的净水原理:___________。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是____。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,丙同学认为氧化性FeO42->MnO4-。请你设计一个实验,验证丙同学的结论是否正确:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。B、C中均加有10mL 1mol/L的NaBr溶液。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量液体放入D中,取下试管并振荡。
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的化学方程式是____________________________________________。
(3)过程Ⅳ中出现的现象是________,由此可证明氧化性较强的是________(填“Br2”或“I2”)。
(4)设计过程Ⅲ的目的是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量CaCl2、MgCl2、Na2SO4等杂质,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液。实验室提纯NaCl的流程如图:

(1)欲除去溶液I中的杂质,写出A所代表的多种试剂,按滴加顺序依次为I.NaOH;Ⅱ.___________;Ⅲ.____________ (填化学式)。
(2)请写出下列试剂加入时发生反应的化学方程式:
①加入试剂I: ____________________________。
②加入盐酸:______________________________________________________.
(3)操作a、b中均用到的玻璃仪器是________、_______(填仪器名称),操作c的名称为___________________。
(4)如何对操作b所得到的沉淀进行洗涤:________________________。
(5)经过操作b后,如何检验所得溶液中的SO42-已除去:______________。
(6)若上述流程中未进行操作b,即直接向溶液I中加盐酸到pH为45,过滤,得到沉淀X和溶液Y,则沉淀X为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4HS置于密闭容器中,在某温度下发生下列反应:NH4HS(s)NH3(g)+H2S(g), H2S(g)H2(g)+S(g)。当反应达到平衡时C(H2)=0.5 mol/L,C(H2S)=4.0 mol/L,则第一步的平衡常数为
A. 16 (mol/L)2 B. 18 (mol/L)2
C. 20.25 (mol/L)2 D. 22 (mol/L)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO![]() N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是
N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是

A. 加催化剂 B. 降低温度
C. 增大NO的浓度 D. 缩小容器体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com