
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
分析 (1)①根据温度对化学平衡的影响考虑;
②向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,设参与反应的为SO2为x,列三段式,根据温度相同、体积相同,气体的物质的量之比=气体的压强之比,解得x,再由v=$\frac{△c}{△t}$计算;
③II与Ⅰ比较,反应速率加快,但平衡状态一样,应为使用催化剂;
(2)①根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算;
②根据温度对化学平衡的影响结合对数可得;
(3)由△H=反应物的总键能-生成物的总键能计算可得;
(4)正极得电子发生还原反应,结合总反应产物可得正极电极反应式;阳离子移向正极.
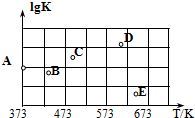
解答 解:(1)①升高温度,K值减小,该反应为放热反应,该反应的△H<0,故答案为:<;
②向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,设参与反应的为SO2为x,则:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
n始:0.04 0.04 0.04 0
n转:x x x 2x
n平:0.04-x 0.04-x 0.04-x 2x
由表可知,4min达到平衡,温度相同、体积相同,气体的物质的量之比=气体的压强之比,则 $\frac{{p}_{平}}{{p}_{始}}$=$\frac{0.12-x}{0.12}$=$\frac{5.0p0}{6.0p0}$,解得x=0.02mol,则反应开始至达到平衡时,v(SOCl2)=$\frac{0.02mol×2÷2L}{4min}$=0.005mol/(L•min);
故答案为:0.005mol/(L•min);
③II与Ⅰ比较,达到平衡所用时间段,说明反应速率加快,但平衡状态一样,应为使用催化剂;
故答案为:使用催化剂;
(2)①根据(1)可知,373K时:
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)
c平:0.01 0.01 0.01 0.02
则化学平衡常数K=$\frac{0.0{2}^{2}}{0.0{1}^{3}}$=400,则A点的数值为lgK=lg400=2.6;
故答案为:2.6
②该反应为放热反应,升高温度,K值减小,lgK减小,故A可能变化为B、E两点;
故答案为:BE;
(3)反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,设1molCl2(g)分子中化学键断裂时需吸收的能量为Q,则△H=1064+4×Q-4×510=-4,解得Q=243;
故答案为:243;
(4)正极得电子发生还原反应,结正极电极反应式为:2SOCl2+4e-=S+SO2↑+4Cl-;阳离子移向正极,所以电解质中锂离子移向正极,
故答案为:2SOCl2+4e-=S+SO2↑+4Cl-;正极.
点评 本题考查了化学平衡的有关计算,温度对化学平衡的影响,键能与反应热的关系以及原电池的原理,综合性强,题目难度不大,考生注意基础知识的把握与计算.


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
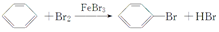 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳氧化物研究
碳氧化物研究| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
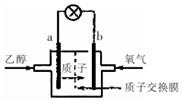 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com