
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 在稀硫酸中加铜片 | 无明显变化 |
| Ⅱ | 在硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 在稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝色 |
分析 (1)①实验Ⅰ是证明铜不与稀硫酸反应,实验Ⅱ是验证铜和硝酸根离子不能反应;
②稀硫酸中加入硝酸钠溶液中,形成了稀硝酸,再加入铜片被稀硝酸氧化生成硝酸铜、一氧化氮和水;
(2)①过氧化氢具有氧化性,将铜氧化成了铜离子;
②铜与稀硫酸不反应是非自发的反应,需要设计成电解池发生,铜溶于稀硫酸并生成氢气,铜做阳极,稀硫酸做电解质溶液,阴极可为石墨.
解答 解:(1)①实验Ⅰ是证明铜不与稀硫酸反应,实验Ⅱ是验证铜和硝酸根离子不能反应,
故答案为:证明Cu不与H+、NO3-单独反应;
②稀硫酸中加入硝酸钠溶液中,形成了稀硝酸,再加入铜片被稀硝酸氧化生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)①将铜片放入盛有稀硫酸的烧杯中,不断向稀硫酸中加入过氧化氢并加热烧杯,发现铜片开始溶解,溶液逐渐变蓝色,过氧化氢具有氧化性,将铜氧化成了铜离子;
故答案为:作氧化剂,将铜氧化为铜离子;
②铜与稀硫酸不反应是非自发的反应,需要设计成电解池发生,铜溶于稀硫酸并生成氢气,铜做阳极,稀硫酸做电解质溶液,阴极可为碳(石墨),装置图为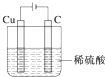 ,
,
故答案为: .
.
点评 本题考查了稀硝酸的性质应用,电解原理的应用,电解原理的理解是解题关键,题目难度中等.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4 OH-═[Al (OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2═CO32-+H2O | |
| D. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C4H10O3 | B. | C5H12O4 | C. | C4H12O4 | D. | C5H12O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
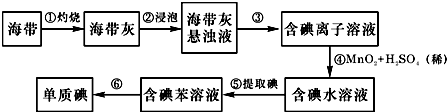
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
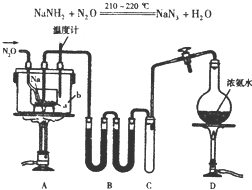 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com