
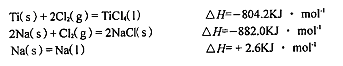


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
 CO(g) + 3H2(g) ¦¤H =" +206.2" kJ/mol
CO(g) + 3H2(g) ¦¤H =" +206.2" kJ/mol CO2(g) +4H2(g) ¦¤H = +165.0kJ/mol
CO2(g) +4H2(g) ¦¤H = +165.0kJ/mol CO(NH2)2 (l) + H2O (l)£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŗĶĪĀ¶Č¹ŲĻµČēĻĀ£ŗ
CO(NH2)2 (l) + H2O (l)£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŗĶĪĀ¶Č¹ŲĻµČēĻĀ£ŗ| T / ”ę | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 £¬ĻĀĶ¼ŹĒ°±Ģ¼±Č£Øx£©ÓėCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©µÄ¹ŲĻµ”£ĒóĶ¼ÖŠµÄBµć“¦£¬NH3µÄĘ½ŗā×Ŗ»ÆĀŹ”£
£¬ĻĀĶ¼ŹĒ°±Ģ¼±Č£Øx£©ÓėCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©µÄ¹ŲĻµ”£ĒóĶ¼ÖŠµÄBµć“¦£¬NH3µÄĘ½ŗā×Ŗ»ÆĀŹ”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 4NO(g)+6H2O(g) ”÷H =" ”Ŗ905" kJ/mol ¢ŁÖ÷·“Ó¦
4NO(g)+6H2O(g) ”÷H =" ”Ŗ905" kJ/mol ¢ŁÖ÷·“Ó¦ 2N2(g)+6H2O(g) ”÷H =" ”Ŗ1268" kJ/mol ¢Śø±·“Ó¦
2N2(g)+6H2O(g) ”÷H =" ”Ŗ1268" kJ/mol ¢Śø±·“Ó¦
 2NO(g)µÄ·“Ó¦ČȦ¤H=
2NO(g)µÄ·“Ó¦ČȦ¤H= ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®330 kJ | B£®276.67 kJ | C£®130 kJ | D£®76.67 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 2NH3(g)”÷H<0
2NH3(g)”÷H<0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®ŌŚ100 ”ę£®101 kPaĢõ¼žĻĀ£¬ŅŗĢ¬Ė®µÄĘų»ÆČČĪŖ40£®69 kJ”¤mol-1£¬ŌņH2O(g) H2O(l) µÄ¦¤H ="+" 40£®69 kJ”¤mol-1 H2O(l) µÄ¦¤H ="+" 40£®69 kJ”¤mol-1 |
| B£®ŅŃÖŖMgCO3µÄKsp = 6£®82 ”Į 10-6£¬ŌņĖłÓŠŗ¬ÓŠ¹ĢĢåMgCO3µÄČÜŅŗÖŠ£¬¶¼ÓŠc(Mg2+) = c(CO32-)£¬ĒŅc(Mg2+) ”¤ c(CO32-)= 6£®82 ”Į 10-6 |
| C£®³£ĪĀĻĀ£¬ŌŚ0£®10 mol”¤L-1µÄNH3”¤H2OČÜŅŗÖŠ¼ÓČėÉŁĮæNH4Cl¾§Ģ壬ÄÜŹ¹NH3”¤H2OµÄµēĄė¶Č½µµĶ£¬ČÜŅŗµÄpH¼õŠ” |
| D£®ŅŃÖŖ£ŗ |
| ¹²¼Ū¼ü | C£C | C=C | C£H | H£H |
| ¼üÄÜ/ kJ”¤mol-1 | 348 | 610 | 413 | 436 |
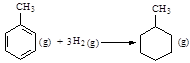 µÄ¦¤HĪŖ£384 kJ”¤mol-1
µÄ¦¤HĪŖ£384 kJ”¤mol-1²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®+283.5kJ”¤mol£1 | B£®+172.5kJ”¤mol£1 |
| C£®£172.5kJ”¤mol£1 | D£®£504kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com