
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。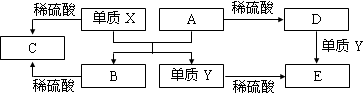
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe  Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
C
解析试题分析:由题目可知中间的反应为置换反应,又由X和Y均能与酸反应,说明是金属置换金属的反应,同时由高温条件和题目中所说的常见化合物,可知是铝热反应,X为单质铝,A为三氧化二铁,Y为铁,B为氧化铝,C为硫酸铝,D为硫酸铁,而三价铁离子与单质铁可以发生氧化还原反应生成亚铁离子,E为硫酸亚铁。由此可知,A选项应为铝热反应方程式;B选项中硫氰化铁为络合物,属于弱电解质但并非沉淀,不能加沉淀符号;C选项为铁与水的置换反应,题中特意强调在一定条件下,常温下除金属钾、钙、钠外其他金属无法与水发生置换反应,但在高温条件下,铁可以与水蒸气发生反应,生成氢气;D选项,两性化合物主要是指即能与酸反应又能与碱反应的化合物,主要包括两性氧化物和两性氢氧化物,氧化铝是典型的两性氧化物,氢氧化铝是典型的两性氢氧化物,但是硫酸铝不是两性化合物。综上C为正确答案。
考点:考查无机物金属与非金属框架推断的相关知识点


科目:高中化学 来源: 题型:实验题
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
如果要在实验室制取SO2,选用上述两种方法中的 (填“途径I”或“途径II”)更合理,你的理由是 (答出一点就可)。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。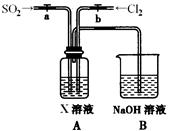
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。装置B、C、D的作用分别是:
B: ;
C: ;
D: 。
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。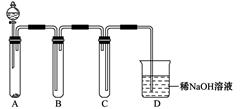
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为: ,说明二氧化硫具有 性。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:
下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。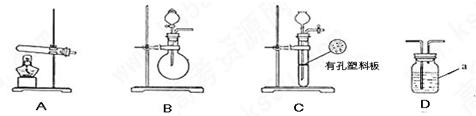
实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积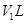 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙.硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水.氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: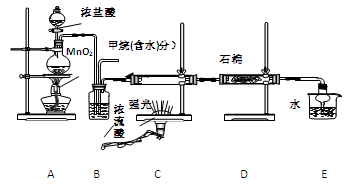
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B为单质,C为化合物。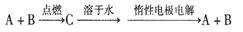
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。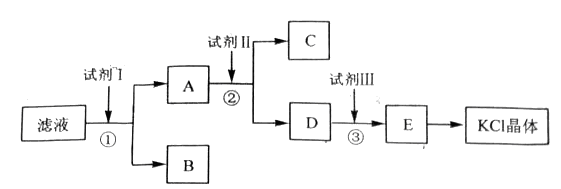
回答下列问题:
(1)起始滤液的pH_____7(填“大于”“小于”或“等于”),其原因是______________________________;(用离子方程式表示)
(2)试剂Ⅰ的化学式为___________,①中发生反应的离子方程式为_______________;
(3)试剂Ⅱ的化学式为____________,②中加入试剂Ⅱ的目的是__________________;
(4)试剂Ⅲ的名称是_____________,③中发生反应的离子方程式为________________;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B ;C ;
沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式)
① ;② ;
③ ; ④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )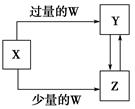
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | 稀HNO3 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | O2 | Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com