
分析 晶体慢慢熔化,试管口附近有大量水蒸气凝结,说明含有水蒸气,取少量晶体溶于水,向其中逐渐滴加浓NaOH溶液,开始有大量白色沉淀产生,后白色沉淀消失,且伴随刺激性气味气体生成,该气体能使湿润pH试纸变蓝说明是氨气,晶体中含有铝离子、铵根离子,称量4.53g晶体,完全溶于水,向其中先加入稀盐酸无明显变化,再加入足量BaCl2溶液,产生大量白色沉淀,经定量测定,该沉淀质量为4.66g,为硫酸钡沉淀,说明晶体中含硫酸根离子,结合质量计算物质的量得到化学式中微粒的物质的量之比.
(1)白色沉淀消失是氢氧化铝溶解于强碱生成偏铝酸钠和水,刺激性气味气体生成,该气体能使湿润pH试纸变蓝说明是氨气是铵根离子和氢氧根离子反应生成氨气和水;
(2)溶于盐酸无现象,加入氯化钡生成白色沉淀为硫酸钡沉淀,证明晶体含硫酸根离子;
(3)晶体物质的量=$\frac{4.53g}{453g/mol}$=0.01mol,含硫酸根离子物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,则化学式中含硫酸根离子2个,结合元素化合价代数和为0得到硫酸铝铵化学式,计算得到结晶水物质的量,确定化学式.
解答 解:晶体慢慢熔化,试管口附近有大量水蒸气凝结,说明含有水蒸气,取少量晶体溶于水,向其中逐渐滴加浓NaOH溶液,开始有大量白色沉淀产生,后白色沉淀消失,且伴随刺激性气味气体生成,该气体能使湿润pH试纸变蓝说明是氨气,晶体中含有铝离子、铵根离子,称量4.53g晶体,完全溶于水,向其中先加入稀盐酸无明显变化,再加入足量BaCl2溶液,产生大量白色沉淀,经定量测定,该沉淀质量为4.66g,为硫酸钡沉淀,说明晶体中含硫酸根离子,结合质量计算物质的量得到化学式中微粒的物质的量之比.
(1)白色沉淀消失是氢氧化铝溶解于强碱生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,刺激性气味气体生成,该气体能使湿润pH试纸变蓝说明是氨气是铵根离子和氢氧根离子反应生成氨气和水,反应的离子方程式为:NH4++OH-=NH3↑+H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;NH4++OH-=NH3↑+H2O;
(2)溶于盐酸无现象,加入氯化钡生成白色沉淀为硫酸钡沉淀,证明晶体含硫酸根离子,故答案为:SO42-;
(3)晶体物质的量=$\frac{4.53g}{453g/mol}$=0.01mol,含硫酸根离子物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,则化学式中含硫酸根离子2个,结合元素化合价代数和为0得到硫酸铝铵化学式,NH4Al(SO4)2计算得到结晶水物质的量,n(H2O)=$\frac{4.53-0.01mol×237g/mol}{18g/mol}$=0.12mol,化学式为:NH4Al(SO4)2•12H2O,
故答案为:NH4Al(SO4)2•12H2O.
点评 本题考查了物质组成的实验探究、微粒反应特征现象的判断、化学式计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 该溶液中,Ag+、K+、NO3?、Mg2+可以大量共存 | |
| B. | 该溶液中,H+、NH4+、SO42?、I?可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023 | |
| D. | 向该溶液中滴入少量Na2SO3溶液,反应的离子方程式为:SO32?+ClO?═Cl?+SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.1 mol/(L•min) | B. | v (N2)=0.6 mol/(L•min) | ||
| C. | v (N2)=0.02mol/(L•s) | D. | v (H2)=0.3 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)x中的x为3 | |
| B. | 标准状况下产生4.48LNO,就有0.5 mol电子转移 | |
| C. | 稀HNO3在反应中只作氧化剂 | |
| D. | 磁性氧化铁中的铁元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.曾侯乙编钟 (青铜器) | B.景德镇瓷器 | C.钢化玻璃 | D.航天服 (涤纶) |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.
某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
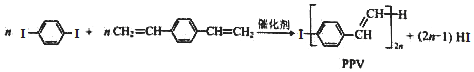
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 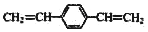 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法可测定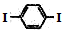 的相对分子质量 的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于氧化还原反应 | |
| B. | 反应中Al被氧化,NO3-被还原 | |
| C. | ?内的物质可能是H2O | |
| D. | 若有1molAl参加反应,则有1molNO3-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com