
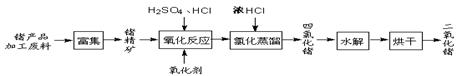



科目:高中化学 来源:不详 题型:单选题
A.3MnO2 + 4Al 3Mn + 2Al2O3 3Mn + 2Al2O3 | B.2AlCl3(熔融)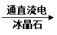 2Al + 3Cl2 2Al + 3Cl2 |
C.Fe2O3 + 3CO 2Fe + 3CO2 2Fe + 3CO2 | D.2HgO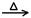 2Hg+ O2↑ 2Hg+ O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 SrSO4(s)+CO
SrSO4(s)+CO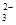 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO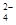 (aq)
(aq)查看答案和解析>>
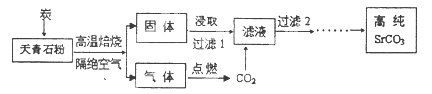
科目:高中化学 来源:不详 题型:填空题
| A.作为燃料,为炼铁中的化学反应反应(删去)提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.作为熔剂,除去铁矿石中的杂质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
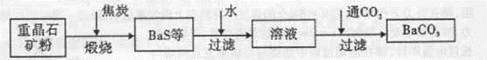
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
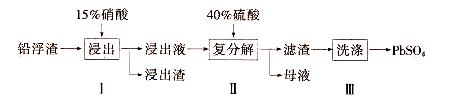
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 冶炼原理 | 方法 |
| A | 2HgO 2Hg + O2 ↑ 2Hg + O2 ↑ | 热分解法 |
| B | 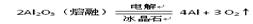 | 电解法 |
| C | Cu2S+ O2 2Cu + SO2 2Cu + SO2 | 热分解法 |
| D | Fe2O3 + 2Al 2 Fe + Al2O3 2 Fe + Al2O3 | 热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com