
| A�� | ����Ӧ����v����CH4��=v����CO��ʱ�������÷�Ӧ��ƽ��״̬ | |
| B�� | ������������ʱ��������ϵѹǿ����Ӧ�١����м����ת���ʾ���С | |
| C�� | ʹ�ø�Ч�������Լӿ췴Ӧ���ʣ�ͬʱ���CH4��ת���� | |
| D�� | ͬһ������ͬʱ������Ӧ�����ʱ���������¶ȿ��ܱ��ֲ��� |
���� A�����淴Ӧ�������ʱ��Ӧ�ﵽƽ��״̬��
B������ѹǿƽ�������������С�ķ����ƶ���
C��������Ӱ��ƽ���ƶ���
D��һ�����ȷ�Ӧ��һ�����ȷ�Ӧ��ͬһ�����У����Ⱥ����ȿ����������������¶ȱ仯�����ԣ�
��� �⣺A����Ӧ����v����CH4��=v����CO��ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����A��ȷ��
B����Ӧ�١��ڶ�������Ӧ�����������ķ�Ӧ����ѹƽ�������ƶ�����Ӧ��ת���ʼ�С����B��ȷ��
C������ֻ�ܹ��ӿ컯ѧ��Ӧ���ʣ���Ӱ��ƽ���ƶ������Բ�������Ӧ���ת���ʣ���C����
D�����Ⱥ���������ʱ���������¶ȱ��ֲ��䣬��D��ȷ��
��ѡC��
���� ���⿼���˻�ѧƽ��״̬���жϡ���ѧƽ���ƶ��������Ի�ѧƽ���Ӱ���Լ���Ӧ�ȵ����֪ʶ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
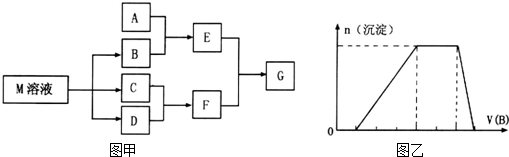

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
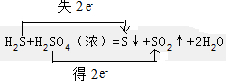 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO32-��Cl- | B�� | Na+��Cu2+ | C�� | Mg2+��C1- | D�� | C1-��Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
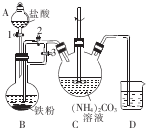 ��������{[CH3CH��OH��COO]2Fe}�㷺Ӧ��������Ʒ��Ӫ��Һ�ȣ�����ˮ������������FeCO3��Ӧ�Ƶã�
��������{[CH3CH��OH��COO]2Fe}�㷺Ӧ��������Ʒ��Ӫ��Һ�ȣ�����ˮ������������FeCO3��Ӧ�Ƶã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ż�ʱʹ����ĭ�������� | |
| B�� | ���Թܼ���̼�����ƹ���ʱʹ�Թܿ���ֱ���� | |
| C�� | Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ | |
| D�� | ����������������ʵ���ҵ��������ʱ��Ӧ������������Ʒۣ�Ȼ������ɨ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com