
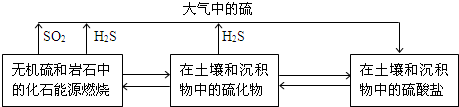
 HSO3-+H+��HSO3-
HSO3-+H+��HSO3- SO32-+H+���ʴ�Ϊ��H2SO3
SO32-+H+���ʴ�Ϊ��H2SO3 HSO3-+H+��HSO3-
HSO3-+H+��HSO3- SO32-+H+��
SO32-+H+�� HSO3-+H+��HSO3-
HSO3-+H+��HSO3- SO32-+H+�����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�����������Ӧ��ͬʱ��Ҫ�������������
SO32-+H+�����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�����������Ӧ��ͬʱ��Ҫ������������� HSO3-+H+��HSO3-
HSO3-+H+��HSO3- SO32-+H+�����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�
SO32-+H+�����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�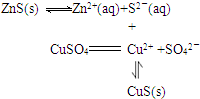 ��ZnS��s��+Cu2+��aq��
��ZnS��s��+Cu2+��aq�� CuS��s��+Zn2+��aq����
CuS��s��+Zn2+��aq����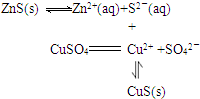 ��ZnS��s��+Cu2+��aq��
��ZnS��s��+Cu2+��aq�� CuS��s��+Zn2+��aq����
CuS��s��+Zn2+��aq����

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
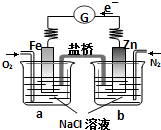
| A�����Ӵ�Zn������������Fe���������Żص�Zn�� |
| B���ձ�a�з�����ӦO2+2H2O-4e-�T4OH-����ҺpH���� |
| C�����ձ�a�м�������K3Fe��CN��6��Һ������ɫ�������� |
| D���ձ�b�з����ĵ缫��ӦΪZn-2e-�TZn2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��SO2��NO2��CO2���������������� |
| B������ͺ�һ�ȼ��鶼�������� |
| C��HC1O��������ʣ�NaClOȴ����ǿ����� |
| D����ˮ��Һ���ܵ����H+�Ļ����ﶼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
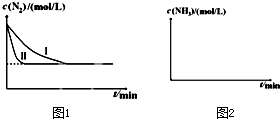
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
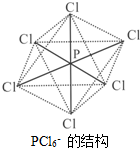 ����������ͬ����Ԫ�أ��㷺��������������ĸ��������У�
����������ͬ����Ԫ�أ��㷺��������������ĸ��������У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
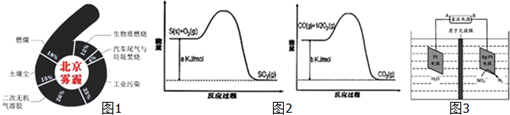
| ���� |
| 180�� |
| ���� |
| ClO2 |
| ��Ӧ�� |
| Na2SO3ˮ��Һ |
| ��Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
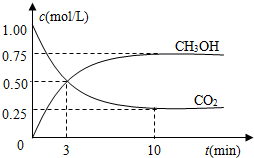 �������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�
�������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�| n(CH3OH) |
| n(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | X | Y | Z | R | T |
| ԭ�Ӱ뾶/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| ��Ҫ���ϼ� | +1 | +2 | +3 | +6��-2 | -2 |
| A���⻯��ķе�ΪH2T��H2R |
| B��Y2+�İ뾶��T2-�İ뾶�� |
| C��Z2R3������ˮ��Һ�д��� |
| D��Ԫ��X��T�γɵĻ������в����ܺ��й��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȼ�Һ��ϴ���ı��������ʱ����������ð�� |
| B����⾫��ͭ������������ҺŨ�Ȳ��� |
| C��Fe2+��H+��NO3-���߲������ԭ��Ϊ��3Fe2++4H++NO3-�T3Fe3++NO��+2H2O |
| D��Ӳ��������Ϊ��Ҫ�Ͻ�Ԫ�صĺϽ���ϣ����۵���ڴ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com