
|
下列关于等体积、等pH的NaOH和氨溶液的说法正确的是 | |
A. |
两种溶液中OH-的浓度相同 |
B. |
需要等浓度、等体积的盐酸中和 |
C. |
温度升高10℃,两溶液的pH仍相等 |
D. |
两种溶液中溶质的物质的量浓度相同 |
科目:高中化学 来源: 题型:阅读理解
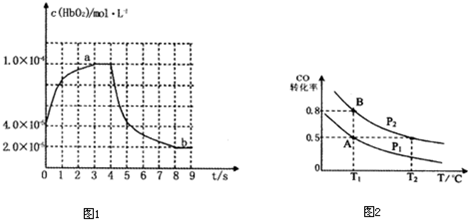
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、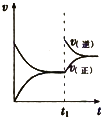 表示:反应I2(g)+H2(g)?2HI(g)△H<0的v-t关系,其中t1时刻改变的条件为升高温度 | B、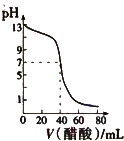 表示:25℃时,用醋酸溶液滴定40.00mL 0.1000mol?L-1 NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol?L-1 | C、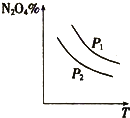 表示:反应2NO2(g)?N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 | D、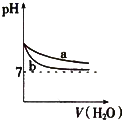 表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水 |
查看答案和解析>>
科目:高中化学 来源:非常讲解·教材全解全析 高中化学 必修1 (山东版) 山东版 题型:013
|
将质量分数为p的硫酸与等体积的水混合后得到质量分数为q的硫酸.则下列关于p、q的关系式中正确的是 | |
| [ ] | |
A. |
q<p<2q |
B. |
p<2q |
C. |
p=2q |
D. |
p≥2q |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:选择题
关于下列图像的叙述正确的是

A.图I表示:反应I2(g)+H2(g)  2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g)  N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市宝山区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是 mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com