解答:
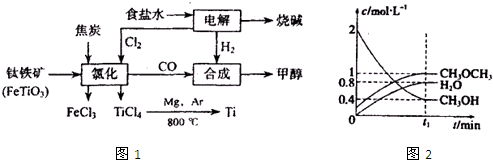
解:(1)根据实验原理可知,先从乙烯的发生装置己出发,经过装置丙除去乙烯中混有的二氧化碳和二氧化硫,经乙干燥,即A连接E,D连接C,然后加入乙烯的燃烧装置甲,B连接F,吸收二氧化碳和水时,应该先吸收水分,再吸收二氧化碳,所以G连接H、I连接J,故正确的连接顺序为:A→E→D→B→C→F→G→H→I→J,
故答案为:A;E;D;B;C;F;G;H;I;J;
(2)浓硫酸在反应中起催化剂和脱水剂作用,加热液体混合物,为防暴沸,需加碎瓷片;
故答案为:催化剂和脱水剂;防暴沸;
(3)乙醇在浓硫酸催化作用下在反应过程中140℃时会反应生成乙醚副产物,乙醇在浓硫酸作用下加热反应过程中发生副反应浓硫酸的脱水性使乙醇脱水为炭,
故答案为:防止生成乙醚;浓硫酸的脱水性使乙醇脱水为炭;
(4)乙烯和浓硫酸反应有副反应发生,所以要用丙除去乙烯中杂质气体二氧化碳和二氧化硫,用乙干燥乙烯,故答案为:干燥乙烯;除去乙烯中的杂质气体;
(5)分析装置和作用可知,丁质量增加ag是有机物燃烧生成的水的质量,戊质量增加bg为有机物燃烧生成的二氧化碳的质量,n(CO
2)=
,n(H
2O)=
,有机物中碳元素、氢元素的物质的量之比n(C):n(H)=
:
×2=
,
故答案为:
;
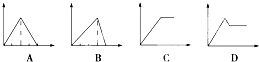
(6)测定乙烯分子中碳、氢原子的个数比偏高说明乙烯气体中有含有碳元素的气体,
A.乙烯中混有少量的乙醚(C
2H
5OC
2H
5),乙醚碳元素和氢元素之比2:5,小于乙烯中碳氢之比2:4,所以混有乙醚会使碳、氢原子的个数比偏低,故A不符合;
B.乙烯进入燃烧管时,含有少量的水蒸气,会使乙烯混合气体中碳氢元素原子数之比小于2:4,所以混有水会使碳、氢原子的个数比偏低,故B不符合;
C.乙烯中混有少量的CO,会使乙烯混合气体中碳氢元素原子数之比大于2:4,所以混有一氧化碳会使碳、氢原子的个数比偏高,故C符合;
D.乙烯进入燃烧管时,含有少量的CO
2 ,会使乙烯混合气体中碳氢元素原子数之比大于2:4,所以混有二氧化碳会使碳、氢原子的个数比偏高,故D符合;
故答案为:CD;
(7)丁质量增加4.5g是有机物燃烧生成的水的质量,戊质量增加8.8g为有机物燃烧生成的二氧化碳的质量,
n(CO
2)=
=0.2mol,n(H
2O)=
=0.3mol,有机物中碳元素、氢元素的物质的量之比n(C):n(H)=0.2mol:0.6mol=1:3,
最简式为CH
3,当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C
2H
6,故不需要其他数据.
故答案为:CH
3;当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C
2H
6,故不需要其他数据.




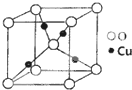 某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.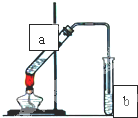 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.