
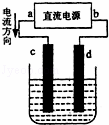
如图所示装置,c、d两极是石墨电极,回答下列问题:
(1)b是 极,c是 极;
(2)若电解质溶液是CuCl2,则c、d两电极的电极反应式是c: ,d: C ,检验c电极产物的方法是 ;
(3)若电解质溶液是滴有酚酞的饱和Na2SO4溶液,在恒定温度下电解一段时间后将直流电源拆除,在电解过程中除观察到两极上产生气泡外, 极附近溶液出现红色,将c、d用导线连接并接上电流计,发现电流计发生偏转,此时c电极发生的电极反应式是 ;
(4)若电解质溶液是CuSO4溶液,则c电极上发生的电极反应式是 ,随着电解的进行,溶液的pH将 (填“增大”、“减小”、“不变”),电解一段时间溶液仍为蓝色时停止电解,要使溶液回复到与电解前完全相同,此时应向溶液中加入 .
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | (1)根据图中电流的流向判断正负极,电解池中与负极相连的为阴极,与之间相连的为阳极; (2)阳极上氯离子失电子生成氯气,根据氯气的氧化性检验;阴极铜离子得电子生成铜单质; (3)根据电解滴有酚酞的饱和Na2SO4溶液,本质是电解水,阳极c生成氧气,阴极d生成氢气,剩余氢氧根离子;将直流电源拆除相当于氢氧燃料电池,c极为正极氧气得电子生成氢氧根,据此分析; (4)电解质溶液是CuSO4溶液,则c电极为氢氧根失电子生成氧气,阴极上铜离子放电,电池反应式为:2CuSO4+2H2O |
| 解答: | 解:(1)由图可知电流从a流向b,则a为电池的正极,b为负极,c与正极相连,所以c为阳极; 故答案为:负;阳; (2)阳极上氯离子失电子生成氯气,其电极反应式为:2Cl﹣﹣2e﹣=C12↑,氯气具有较强的氧化性能使湿润的淀粉碘化钾试纸变蓝;阴极上铜离子得电子生成铜,其电极反应式为:Cu2++2e﹣=Cu, 故答案为:2Cl﹣﹣2e﹣=C12↑;Cu2++2e﹣=Cu;用湿润的淀粉碘化钾试纸检验; (3)电解滴有酚酞的饱和Na2SO4溶液,本质是电解水,阳极c生成氧气,阴极d生成氢气,剩余氢氧根离子,所以d极附近溶液出现红色;将直流电源拆除相当于氢氧燃料电池,c极为正极氧气得电子生成氢氧根,反应式为:O2+2H2O+4e﹣=4OH﹣;故答案为:d;O2+2H2O+4e﹣=4OH﹣; (4)电解质溶液是CuSO4溶液,则c电极为氢氧根失电子生成氧气,反应式为:4OH﹣﹣4e﹣=O2+2H2O,阴极上铜离子放电,电池反应式为:2CuSO4+2H2O |
| 点评: | 本题考查原电池与电解池的工作原理,明确离子放电顺序、电极反应式的书写即可解答,难度不大. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各组顺序的排列不正确的是( )
A.熔点:金刚石>食盐>干冰 B.热稳定性:HCl>H2S>PH3
C.沸点:HF>HBr>HCl D.离子半径:Na+<Mg2+<Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
【观察与思考】
(1)乙醇分子的核磁共振氢谱有 个吸收峰.
【活动与探究】
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象就填多少,不必填满).
| 实验现象 | 结论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② | ||
(3)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) .欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在水浴中加热,观察现象即可,此反应的化学方程式为 .
【交流与讨论】
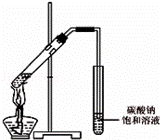
(4)丙同学向一支试管中加入3mL乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按图所示连接好装置,开始实验.请回答下列问题:
①请指出该装置的主要错误是 .
②浓硫酸的作用是 、 .
③假如乙醇分子中的氧原子为18O,请写出此反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的( )
|
| A. | 化学反应速率大小的决定因素是反应物的性质 |
|
| B. | 所有化学反应,温度升高其反应速率一定增大 |
|
| C. | 钢铁腐蚀、熟料老化、食物腐败等都是化学变化,减小这些反应的速率有利于生产、生活及可持续发展 |
|
| D. | 硫酸工业、硝酸工业、铁的冶炼等都涉及到化学反应且都会产生污染,减小这些反应的速率有利于降低对环境的污染也有利于国民经济的可持续发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有Wn+、Xm+、Ym﹣、Zn﹣四种离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数.下列说法中正确的是( )
|
| A. | Wn+、Xm+、Ym﹣、Zn﹣的离子半径依次增大 |
|
| B. | Y、Z的气态氢化物的热稳定性:YHm>HnZ |
|
| C. | W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 |
|
| D. | W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c((Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在化学反应中发生物质变化的同时,不一定发生能量变化
B.ΔH>0表示放热反应,ΔH<0表示吸热反应
C.ΔH的大小与热化学反应方程式中化学计量数无关
D.生成物释放的总能量大于反应物吸收的总能量时,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2(g)+O2(g)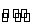 2SO3(g)经过一段时间后,SO3的浓度增加了
2SO3(g)经过一段时间后,SO3的浓度增加了
0.4 mol·L-1,测得在这段时间内用SO2的浓度变化表示的反应速率为
0.04 mol·L-1·s-1,则“这段时间”为( )
A.10 s B.5 s C.2.5 s D.0.1 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com