
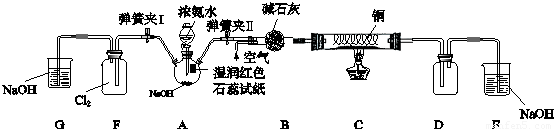
(13分)某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如下图实验(夹持设备略去)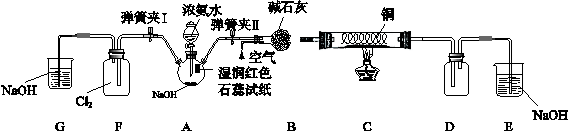
I.检验气密性后关闭弹簧夹I打开弹簧夹II,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯。
II.当D中有明显现象时关闭弹簧夹II;打开弹簧夹I
(1)能证明有氨气产生的现象是 ;氨分子电子式为 。
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为 反应(填“吸热”或“放热”)NH3在
C中反应的化学方程式为 。
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因 ,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1 K2(填“<”“=”“>”)。
(13分)
(1)A中湿润的红色石蕊试纸变蓝; 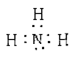 (2分)
(2分)
(2)放热 , 4NH3 +5O2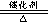 4NO + 6H2O,2NH3 +3CuO
4NO + 6H2O,2NH3 +3CuO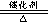 3Cu +N2+ 3H2O (3分)
3Cu +N2+ 3H2O (3分)
(3)HNO3 + NH3 = NH4NO3 (2分)
(4)8:3 (2分)
(5)NH3 + H2O NH3.H2O
NH3.H2O NH4+ + OH- △H ﹤0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气; (2分)
NH4+ + OH- △H ﹤0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气; (2分)
K1小于K2 (2分)
解析试题分析:(1)氨气溶于水显碱性可以使红色石蕊试纸变蓝,所以A中湿润的红色石蕊试纸变蓝能证明有氨气产生,氨分子电子式为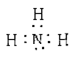 ;
;
(2)说明反应放热为铜丝继续保持保持红热,该反应为4NH3 +5O2 4NO + 6H2O,2NH3 +3CuO
4NO + 6H2O,2NH3 +3CuO 3Cu +N2+ 3H2O;
3Cu +N2+ 3H2O;
(3)D白烟主要是HNO3和NH3反应生成的NH4NO3,所以产生白烟的化学方程式为HNO3 + NH3 = NH4NO3;
(4)F中发生反应3Cl2+8NH3=6NH4CL+N2,则反应物的物质的量之比n(NH3):n(Cl2)为8:3;
(5)A中存在化学平衡NH3 + H2O NH3.H2O
NH3.H2O NH4+ + OH- △H ﹤0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶水放出大量热,也使平衡逆向移动,所以能产生大量NH3气体;化学平衡常数K的大小只有温度决定,三颈瓶中氢氧化钠溶于水放出大量热,溶液温度升高,故K1小于K2。
NH4+ + OH- △H ﹤0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶水放出大量热,也使平衡逆向移动,所以能产生大量NH3气体;化学平衡常数K的大小只有温度决定,三颈瓶中氢氧化钠溶于水放出大量热,溶液温度升高,故K1小于K2。
考点:氮族元素;化学反应平衡
点评:本题考查氮元素物质的还原性及化学反应平衡的知识,有一定的难度,要求考生熟悉掌握相关知识。


科目:高中化学 来源: 题型:阅读理解



| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期期末考试化学试卷(解析版) 题型:实验题
(13分)某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如下图实验(夹持设备略去)
I.检验气密性后关闭弹簧夹I打开弹簧夹II,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯。
II.当D中有明显现象时关闭弹簧夹II;打开弹簧夹I
(1)能证明有氨气产生的现象是 ;氨分子电子式为 。
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为 反应(填“吸热”或“放热”)NH3在
C中反应的化学方程式为 。
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因 ,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1 K2(填“<”“=”“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如下图实验(夹持设备略去)

I.检验气密性后关闭弹簧夹I打开弹簧夹II,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯。
II.当D中有明显现象时关闭弹簧夹II;打开弹簧夹I
(1)能证明有氨气产生的现象是 ;氨分子电子式为 。
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为 热反应(填“吸热”或“放热”NH3在C中反应的化学方程式为 。
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因 ,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1 K2(填“<”“=”“>”)。
(6)装置中A稍有不足,应该怎样改进 。
查看答案和解析>>
科目:高中化学 来源:2012年北京市大兴区高考化学一模试卷(解析版) 题型:解答题
 3Cu+N2+3H2O
3Cu+N2+3H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com