
| A | B | C | D | |
| 反应 装置或 图象 |  |  |  |  |
| 实验现 象或图 像信息 | 反应开始 后,针筒活 塞向右移动 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 温度计的 水银柱不 断上升 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Zn与稀硫酸反应生成氢气,氢气可使针筒活塞向右移动;
B.由图可知,反应物总能量大于生成物总能量;
C.甲处液面低于乙处液面,可知瓶内空气受热温度升高;
D.温度计的水银柱不断上升,则中和反应放出热量.
解答 解:A.Zn与稀硫酸反应生成氢气,氢气可使针筒活塞向右移动,不能充分说明相应的化学反应是放热反应,故A选;
B.由图可知,反应物总能量大于生成物总能量,说明相应的化学反应是放热反应,故B不选;
C.甲处液面低于乙处液面,可知瓶内空气受热温度升高,说明相应的化学反应是放热反应,故C不选;
D.温度计的水银柱不断上升,则中和反应放出热量,说明相应的化学反应是放热反应,故D不选;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、现象与结论为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | C(CH3)4 1,1,2,2-四甲基甲烷 | |
| B. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2CH(OH)CH3 2-丁醇 | |
| D. | CH3CH2CH2Br 溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
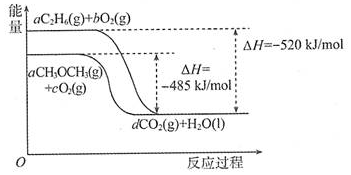
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂能在碱性条件下水解,可用于工业上制取肥皂 | |
| B. | 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘 | |
| C. | 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂 | |
| D. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
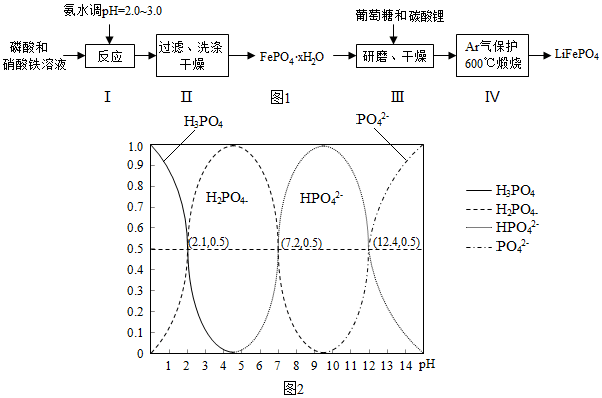
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| S | Cl |
| Se | Br |
| A. | 还原性:Se2->S2->Cl- | B. | 热稳定性:HCl>H2Se>HBr | ||
| C. | 原子半径:Se>Cl>S | D. | 酸性:HBrO4>HClO4>H2SeO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com