
| A、大理石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+=2Fe3++2Cl- |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、酸性氢氧燃料电池的正极反应:H2-2e-=2H+ |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向浓度均为0.1mol?L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>HCO3- |
| C | 向蓝色石蕊试纸上滴加新制氯水 | 试纸边缘呈红色色,中间为白色 | 氯水既有酸性又有还原性 |
| D | 淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴 | 无银镜出现 | 淀粉没有水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
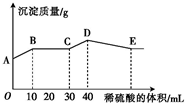 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )| A、AB段发生反应的离子方程式为Ba2++SO42-═BaSO4↓ |
| B、BC段发生反应的离子方程式为H++OH-=H2O |
| C、D点表示的沉淀的化学式为Al(OH)3 |
| D、E点时溶液中含有AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在晶体中只要有阳离子就一定有阴离子 |
| B、晶体中分子间作用力越大,分子越稳定 |
C、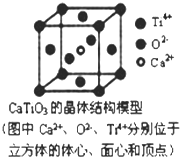 CaTiO3晶体中(晶胞结构如图所示)与每个Ti4+紧邻且等距的O2-有12个 |
| D、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可由有机化工原料R和其他有机试剂通过加成、水解、氧化、缩聚反应得到,则R是( )
可由有机化工原料R和其他有机试剂通过加成、水解、氧化、缩聚反应得到,则R是( )| A、1-丁烯 | B、2-丁烯 |
| C、1,3-丁二烯 | D、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) |
| B、c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| C、HCO3- 的电离程度大于HCO3-的水解程度 |
| D、其电离方程式为:NaHCO3?Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
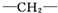 ,一个
,一个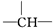 ,则X的结构简式为
,则X的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com