
分析 设出混合物中含有Na2CO3和NaHCO3的物质的量,根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,然后分别根据固体总质量、生成二氧化碳的量列式计算,最后根据m=nM计算出混合物中Na2CO3和NaHCO3的质量.
解答 解:设混合物中含有Na2CO3和NaHCO3的物质的量分别为x、y,
标准状况下4.48L二氧化碳的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据固体的总质量可得:①106x+84y=19,
加入盐酸质量,混合物中所有碳原子都转化成二氧化碳,根据碳原子守恒可知:②x+y=0.2mol,
联立①②解得:$\left\{\begin{array}{l}{x=0.1mol}\\{y=0.1mol}\end{array}\right.$,
则混合物中碳酸钠的质量为:m(Na2CO3)=106g/mol×0.1mol=10.6g,碳酸氢钠的质量为:m(NaHCO3)=84g/mol×0.1mol=8.4g,
答:混合物中Na2CO3的质量为10.6g,NaHCO3的质量为8.4g.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
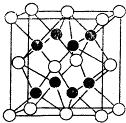 X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):
X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )| A. | 任何分子式中的“•”都表示氢键 | |
| B. | H2O2是极性分子,其结构简式为HO-OH | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | H2NCONH2与H2O2是通过氢键结合的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加少量Na2S溶液:2Fe3++S2-=2Fe2++S↓ | |
| C. | 向硫酸铜溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
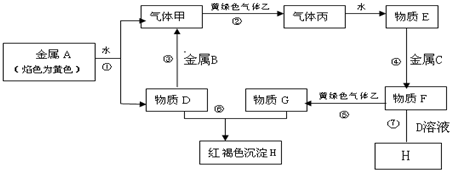
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
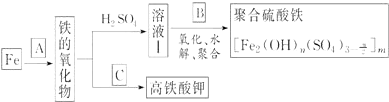
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com