
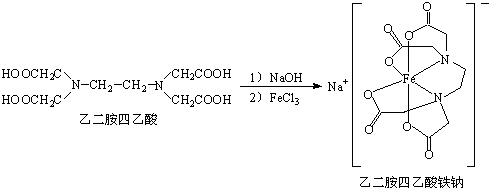
分析 (1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
(2)原子个数相同且价电子数相同的微粒是等电子体;
(3)乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;同周期自左而右电负性增大;
(4)氢键影响物质的溶沸点,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(5)配位键由提供孤电子对的原子指向提供空轨道的原子,该配位原子为N、O原子,中心原子Fe周围与2个氮原子、4个氧原子相连.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为:[Ar]3d5或1s22s22p63s23p63d5,
故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,
故答案为:N2;
(3)乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:sp2、sp3;O>N>C;
(4)分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,故答案为:乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(5)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子Fe具有空轨道,N、O原子含有孤电子对,所以该配合物中的配位键为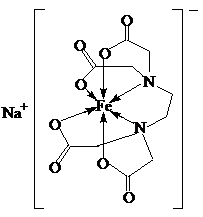
故答案为: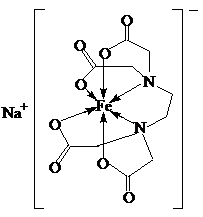
点评 本题是对物质结构的考查,涉及电子的排布、等电子体、电负性大小的判断、杂化方式的判断、配位键等知识,题目综合性较强,难度中等,注意(5)配位键的表示方法、注意氢键对物质熔沸点的影响.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的氧化物是离子化合物 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 常温时Z单质的氧化性比X单质的氧化性弱 | |
| D. | X和 Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
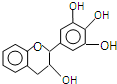 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 该有机物的分子式是C15H13O5 | |
| B. | 1mol EGC与4molNa生成气体体积为44.8L | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 分子中所有的原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(H+)=l×10-13mol/L | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+) | |
| D. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
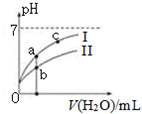 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
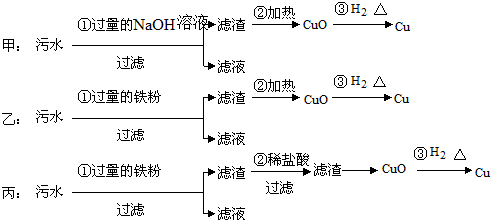
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
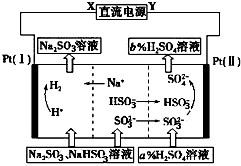 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:③>②>④>① | B. | 原子半径:①>②>④>③ | ||
| C. | 电负性:③>①>②>④ | D. | 最高正化合价:③>①>②>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com