
| 选项 | 现象或事实 | 解释 |
| A | Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉 | Na具有强还原性 |
| B | 明矾可用作净水 | 明矾能杀菌消毒 |
| C | SO2可用于漂白纸浆 | SO2具有强氧化性 |
| D | SiO2可用于制造光导纤维 | SiO2具有导电性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉,该反应中Na是还原剂,还原剂体现还原性;
B.明矾水解生成氢氧化铝胶体而净水;
C.二氧化硫漂白纸浆体现漂白性;
D.二氧化硅是制造光导纤维的主要成分,二氧化硅没有导电性.
解答 解:A.Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉,该反应中Na是还原剂,还原剂体现还原性,所以该反应体系Na的还原性,故A正确;
B.明矾水解生成氢氧化铝胶体具有吸附性而净水,胶体没有强氧化性,所以不能杀菌消毒,故B错误;
C.二氧化硫漂白纸浆体现漂白性,二氧化硫和硫化氢反应体现氧化性,故C错误;
D.二氧化硅是制造光导纤维的主要成分,是利用光全反射原理,二氧化硅没有导电性,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、物质性质及用途,明确基本原理及物质性质是解本题关键,注意明矾净水原理及应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
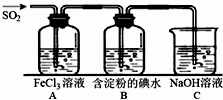 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
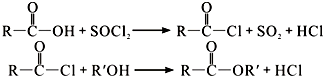
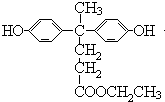
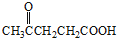 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):
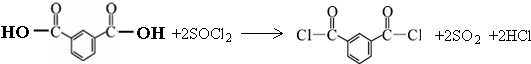 .
. 的路线.
的路线. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 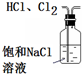 除去HCl中含有的少量Cl2 | B. | 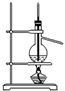 石油的蒸馏 | ||
| C. |  制备乙酸乙酯 | D. |  制备收集干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com