
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)
A.溶液的pH值:②>③>①
B.水电离出的c(OH-):③>①=②
C.①和③等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-)
AC
【解析】
试题分析:浓度相同的情况下,碱性越强pH越大,所以强碱>水解呈碱性的盐>酸,A正确;酸碱均抑制水的电离,而水解盐促进水的电离,所以CH3COONa溶液中水电离的氢氧根浓度最大,又浓度相同的情况下强酸强碱对水的抑制强于弱酸弱碱,所以水电离出的c(OH-):③>①>②,B错误;①和③等体积混合后各溶质浓度减半,所以物料守恒式c(CH3COOH)+ c(CH3COO-)=0.1mol/L,C正确;②和③等体积混合后的溶液物料守恒式子应为c(Na+)=2c(CH3COOH)+2c(CH3COO-),所以D错误;故选AC。
考点:本题考查的是离子浓大小的比较,充分运用弱电解质电离的知识和三大守恒解题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
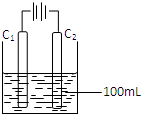 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
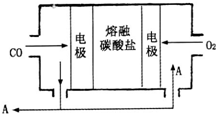 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.
| ||
| ||
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com