
【题目】在催化剂作用下,可逆反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)在温度为323K和343K时SiHCl2的转化率随时间变化的结果如图所示(已知:反应速率v=v正-v逆=k正![]() -k逆
-k逆![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
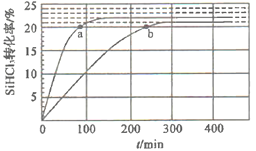
A.343K时,反应的平衡转化率为22%
B.343K时,反应的平衡常数约为0.02
C.323K时,提高反应物压强或浓度可缩短反应达到平衡的时间
D.a处的![]() 1.1,且a处的反应速率大于b处的反应速率
1.1,且a处的反应速率大于b处的反应速率
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】G是良好的生物医药缓释材料,其合成路线:
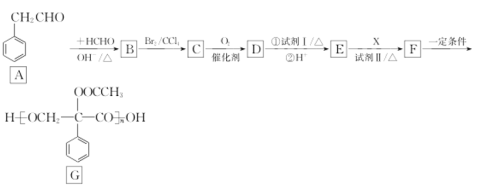
已知: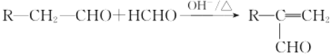
回答下列问题:
(1)A的化学名称为_______;B中官能团的名称为_________。
(2)由F生成G的反应类型为________。
(3)无机试剂I 、II分别为________、__________。
(4)物质X的结构简式是__________。
(5)写出D与试剂I的化学反应方程式:_____________________。
(6)Y是比D多1个碳原子的同系物,写出两种符合下列条件的Y的结构简式:________。
①能与饱和Na2CO3溶液反应放出气体;②苯环上有3个侧链,核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为6:2:1:1。
(7)参照以上合成路线,写出以甲醛、乙醛和乙二醇为主要原料合成功能高分子材料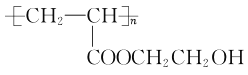 的路线:_______________________________(其他无机试剂任用)。
的路线:_______________________________(其他无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 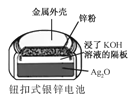 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 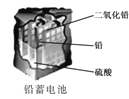 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各图的说法(其中①③④中均为情性电极)正确的是( )

A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。由此产生的![]() 等废气处理意义重大。
等废气处理意义重大。
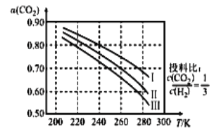
(1)将![]() 应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为
应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为![]() 。如图为
。如图为![]() 平衡转化率和温度、压强的关系,其中压强分别为
平衡转化率和温度、压强的关系,其中压强分别为![]() 。据图可知,该反应为_______反应(填“吸热”或“放热”)。设
。据图可知,该反应为_______反应(填“吸热”或“放热”)。设![]() 的初始浓度为
的初始浓度为![]() ,根据
,根据![]() 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数![]() _________(列式即可)。若4.0Mpa时减小投料比
_________(列式即可)。若4.0Mpa时减小投料比![]() ,则
,则![]() 的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
(2)![]() 时,向某恒温密闭容器中加入一定量的
时,向某恒温密闭容器中加入一定量的![]() 和
和![]() ,发生反应
,发生反应![]() ,反应达到平衡后,在
,反应达到平衡后,在![]() 时刻,改变某条件,
时刻,改变某条件,![]() 随时间(t)的变化关系如图1所示,则
随时间(t)的变化关系如图1所示,则![]() 时刻改变的条件可能是______(填写字母)。
时刻改变的条件可能是______(填写字母)。
a 保持温度不变,压缩容器 b 保持体积不变,升高温度
c 保持体积不变,加少量碳粉 d 保持体积不变,增大![]() 浓度
浓度
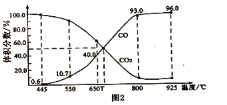
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应![]() ,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②
,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②![]() 的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
(4)已知25℃时,![]() ,此温度下若在实验室中配制100mL 5 molL1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 molL1的盐酸___________mL(忽略加入盐酸体积)。
,此温度下若在实验室中配制100mL 5 molL1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 molL1的盐酸___________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是

A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。

(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列有关叙述正确的是( )
A.2.24LCO2与足量Na2O2反应,转移的电子数目为0.1NA
B.1molCH4与足量的C12在光照下反应生成的CH3C1分子数为NA
C.已知反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
D.在1L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com