
分析 7.8克镁和铝的混合粉,设镁和铝的物质的量分别为xmol和ymol,则24x+27y=7.8,2x+3y=$\frac{8.96L}{22.4L/mol}$×2,解之得x=0.1mol;y=0.2mol,由此分析解答.
解答 解:7.8克镁和铝的混合粉,设镁和铝的物质的量分别为xmol和ymol,则24x+27y=7.8,2x+3y=$\frac{8.96L}{22.4L/mol}$×2,解之得x=0.1mol;y=0.2mol,
(1)原金属混合物中含铝的质量为:0.2×27=5.4克,故答案为:5.4;
(2)Mg2+、Al3+恰好完全沉淀,得到单一溶质氯化钠,根据氯化钠的组成,n(NaOH)=n(HCl)=0.9×1=0.9mol,所以体积为:$\frac{0.9}{2}$=0.45L,故答案为:450;
(3)氢氧化铝的物质的量等于铝的物质的量,而氢氧化铝恰好完全溶解发生的反应为Al(OH)3+NaOH═NaAlO2+2H2O,所以溶解需氢氧化钠的物质的量为0.2mol,所以消耗氢氧化钠的体积为100mL,所以再加入100ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得0.1mol的氢氧化镁沉淀,质量为:0.1×58=5.8g,故答案为:100;5.8.
点评 本题考查镁铝单质及其化合物的性质、混合物的有关计算,注意利用赋值法计算,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 分子结构的下列叙述中,正确的是( )
分子结构的下列叙述中,正确的是( )| A. | 七个碳原子可能不在同一平面上 | B. | 具有单键和双键两种键 | ||
| C. | 八个氢原子不可能都在同一平面上 | D. | 最多可能有5个C原子在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列信息,完成下列各题
阅读下列信息,完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
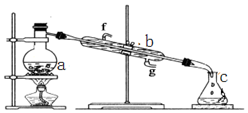
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水、FeCl3溶液 | B. | 溴水、酸性KMnO4溶液 | ||
| C. | 溴水、Na2CO3溶液 | D. | FeCl3溶液、酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 侯式制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com