
| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C6H14 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | NaBH4既是氧化剂也是还原剂 | |
| B. | NaBH4是还原剂,H2O是氧化剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | 被氧化的元素与被还原的元素质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是极性(填“极性”或“非极性”)键形成的非极性分子.
,它是极性(填“极性”或“非极性”)键形成的非极性分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
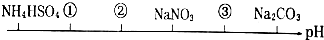
| A. | NH4Cl (NH4)2SO4 CH3COONa | B. | (NH4)2SO4 NH4Cl CH3COONa | ||
| C. | (NH4)2SO4 NH4Cl NaOH | D. | CH3COOH NH4Cl (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 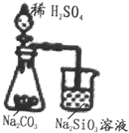 可以用业证明非金属性的相对强弱S>C>Si 可以用业证明非金属性的相对强弱S>C>Si | |
| B. | 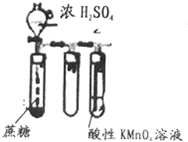 可以用来检验是否有还原性气体生成 可以用来检验是否有还原性气体生成 | |
| C. | 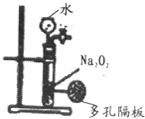 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 | |
| D. |  滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com