
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铝箔插入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在一定的条件下,将10molH2和1molN2充入一密闭容器中,在适当条件下使其发生反应:N2+3H2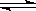 2NH3,达到平衡后。则H2的转化率可能是( )
2NH3,达到平衡后。则H2的转化率可能是( )
A.35% B.30% C.25% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3的说法中不正确的是
A.可用澄清石灰水鉴别这两种物质
B.Na2CO3比NaHCO3更稳定
C.相同条件下0.5 mol/L Na2CO3溶液碱性比NaHCO3 强
D.等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
)镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝合金废料转化为硫酸铝晶体实验流程如下:
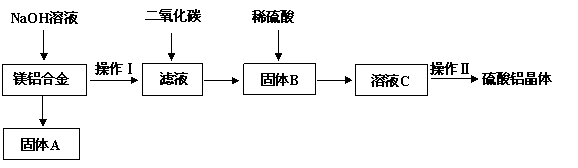
试回答下列问题:
(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式 ▲ ,固体B的化学式 ▲ 。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 ▲ 、 ▲ 、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 ▲ 。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。计算得硫酸铝晶体的化学式为 ▲ 。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知: 。
。
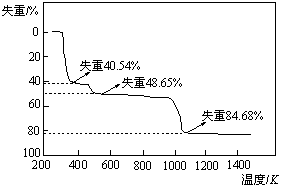 根据图示数据计算确定每步分解的产物,写
根据图示数据计算确定每步分解的产物,写
出第一阶段分解产物的化学式 ▲ ,第三阶段反应化学方程式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2SO4的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为
A.2:3 B.3:8 C.1:4 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+ O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1
 N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2
 N2(g)+
N2(g)+ H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+ O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
|
| A. | 2△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
|
| B. | 2△H3﹣3△H1﹣2△H2 |
|
| C. | 3△H1+2△H2﹣2△H3 |
|
| D. | 3△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
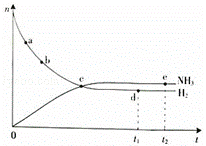
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 .
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com