
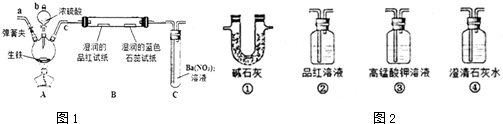
分析 (1)由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸反应生成二氧化硫,可使湿润的品红试纸褪色,湿润的石蕊试纸变红;硝酸具有强氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀;
(2)碳与浓硫酸反应生成二氧化碳、二氧化硫与水;
(3)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳;
由于装置有空气,空气中含有二氧化碳,开始鼓入氮气,排尽装置中的空气,防止空气中的CO2影响实验;
(4)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气.
解答 解:(1)由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸反应生成二氧化硫,可使湿润的品红试纸褪色,湿润的石蕊试纸变红;硝酸具有强氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀,
故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;BaSO4;
(2)碳与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,从左到右的顺序为③②④;
由于装置有空气,空气中含有二氧化碳,开始鼓入氮气,排尽装置中的空气,防止空气中的CO2影响实验,
故答案为:③②④;赶尽装置中的空气,防止空气中的CO2影响实验;
(4)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,反应离子方程式为:Fe+2H+═Fe2++H2↑,
故答案为:Fe+2H+═Fe2++H2↑.
点评 本题考查浓硫酸的性质实验、二氧化硫与二氧化碳的检验等,主要是二氧化硫性质的分析应用,注意二氧化硫、二氧化碳检验先后顺序,二氧化硫不能使酸碱指示剂褪色,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 16种 | B. | 25种 | C. | 36种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com