
分析 酸式滴定管可用来量取酸性、氧化性物质,碱式滴定管能够量取碱性溶液,结合高锰酸钾的性质选择合适的滴定管;
高锰酸钾溶液为紫色,与亚硫酸钠发生氧化还原反应被还原为二价锰离子,滴定终点溶液颜色的变化是利用高锰酸钾溶液的颜色指示反应终点,滴入最后一滴溶液变为紫色且半分钟不再发生变化,据此解答;
解答 解:高锰酸钾具有强的氧化性,能氧化橡胶管,所以应使用酸性式滴定管取用KMnO4溶液,高锰酸钾溶液为紫红色,与亚硫酸钠发生氧化还原反应被还原为二价锰离子,滴定终点溶液颜色的变化是利用高锰酸钾溶液的颜色指示反应终点,滴入最后一滴溶液变为紫色且半分钟不再发生变化;
故答案为:酸;无色变成紫色.
点评 本题考查了滴定法测定物质的浓度,熟悉滴定管构造及高锰酸钾的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
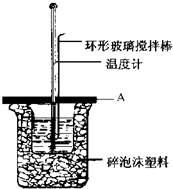 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y可能为气态 | B. | Y一定为固态或液态 | ||
| C. | Z可能为气态 | D. | Z一定为固态或液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等的SO2和CO2 | B. | 密度不同、质量相等的CO和C2H4 | ||
| C. | 等温等体积的NO和HCl | D. | 等压等体积的N2和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
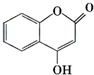 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: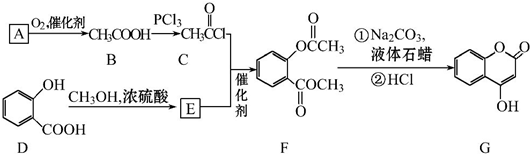
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com