
【题目】将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请计算(写出计算过程):
(1)混合气体中NO和NO2的体积各位多少?______________
(2)被还原的硝酸的物质的量为多少?_________________
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
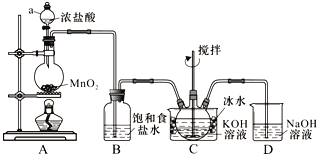
已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯置于冰水浴中,向其中加入________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+2Cl+5I2+4H2O。
③![]()

请回答:
(1) 仪器b在装置中的作用是________;比较仪器c和d,实验中c的优点是________。
(2) 制备装置甲中需改进的一项措施是________。
(3) 反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:________;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________。
(4) 下列有关说法正确的是________。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5) 自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0 mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000 mol·L1 Na2S2O3标准溶液滴定碘单质(I2+2S2O![]() =2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
=2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
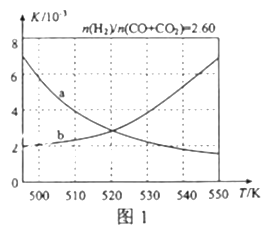
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。
(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:
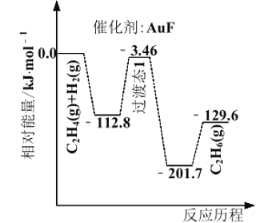

则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 经催化加氢合成乙烯:
经催化加氢合成乙烯:![]() 。恒容条件下,按
。恒容条件下,按![]() 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
①指出图中曲线![]() 分别表示_______、________的浓度。
分别表示_______、________的浓度。
②升高温度,平衡常数![]() _________(“减小”“增大”或“不变”)。
_________(“减小”“增大”或“不变”)。![]() 点,
点,![]() ______(用
______(用![]() 表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。
表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。

(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化![]() 制
制![]() ,产物的选择性高达
,产物的选择性高达![]() ,
,![]() 转化为
转化为![]() 的电极反应式为___________________。
的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
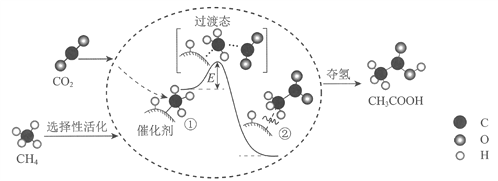
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
A.![]() 溶液与
溶液与![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
B.![]()
![]() 溶液与过量NaOH溶液反应:
溶液与过量NaOH溶液反应:![]()
C.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
D.![]() 溶液中加入过量的HI溶液:
溶液中加入过量的HI溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线上的主族元素性质相 似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是_____________同时生成微量的________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程式为____________________,_____________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________。
(4)用电子式表示BeCl2的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条河边有四座工厂:甲、乙、丙、丁(如图所示),它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种。某环保小组对河水监测时发现:

①甲处河水呈乳白色
②乙处河水有红褐色沉淀
③丙处河水由浑浊变澄清
④丁处河水产生气泡,河水仍澄清
请推断四座工厂排出的废液里含有的物质分别是(填化学式):
甲:___,乙:___,丙:___,丁:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com