
 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.分析 (1)用惰性电极电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气同时生成氢氧根离子;
(2)该反应中H元素化合价由0价变为+1价、Cu元素化合价由+2价变为0价,转移电子数为2;
(3)该铜锌原电池中,Zn易失电子生成锌离子而作负极,Cu作正极,Cu电极上氢离子得电子生成氢气,在外电路中电子从负极沿导线流向正极;
(4)n(H2)=$\frac{1g}{2g/mol}$=0.5mol,0.5mol氢气完全燃烧生成液态水放出142.8kJ热量,则1mol氢气完全燃烧生成液态水放出285.6kJ热量;
(5)原电池能加快化学反应速率.
解答 解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气同时生成氢氧根离子,则电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)该反应中H元素化合价由0价变为+1价、Cu元素化合价由+2价变为0价,转移电子数为2,电子转移方向和数目为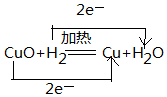 ,
,
故答案为: ;
;
(3)该铜锌原电池中,Zn易失电子生成锌离子而作负极,Cu作正极,Cu电极上氢离子得电子生成氢气,则Cu电极上看到的现象是:有气泡产生,在外电路中电子从负极沿导线流向正极,所以电子从Zn电极沿导线流向Cu电极,
故答案为:Cu电极上产生气泡;电子从Zn电极沿导线流向Cu电极;
(4)n(H2)=$\frac{1g}{2g/mol}$=0.5mol,0.5mol氢气完全燃烧生成液态水放出142.8kJ热量,则1mol氢气完全燃烧生成液态水放出285.6kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(5)Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以在此溶液中加入少量硫酸铜溶液能提高制取氢气的速度,
故答案为:合理;因为Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以该操作能提高制取氢气的速率.
点评 本题考查较综合,涉及原电池和电解池原理、热化学方程式的书写、氧化还原反应等知识点,侧重考查学生对基础知识的理解和掌握,注意(4)中焓变与其计量数有关,题目难度不大.


科目:高中化学 来源: 题型:实验题
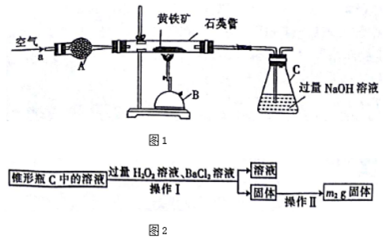
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
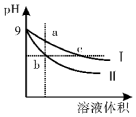
| A. | b、c两点溶液的导电能力b>c | |
| B. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc | |
| C. | c点溶液中c(H+)=c (OH-)+c(CH3COOH) | |
| D. | a、b、c三点溶液中水的电离程度a>c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
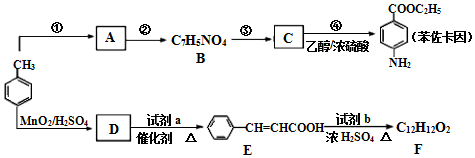

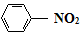 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$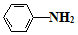 (易被氧化)
(易被氧化)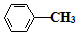 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$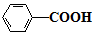
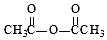 .
.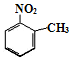 、
、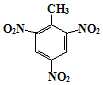
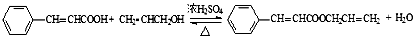 .
.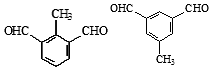 (任写一种).
(任写一种).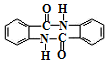 )的合成路线(无机试剂任选).
)的合成路线(无机试剂任选).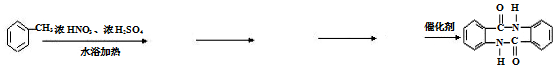
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向浓度均为0.lmol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
| C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和SO32- |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+KSCN?Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | |
| B. | 氯化氢的电子式: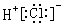 | |
| C. | 镁原子结构示意图: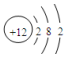 | |
| D. | 氢氧化钠的电离方程式:NaOH═Na++O2-+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com