
 �о���Ԫ�ؼ��仯��������ʾ�����Ҫ���壮
�о���Ԫ�ؼ��仯��������ʾ�����Ҫ���壮 ��
��| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-4 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
���� ��1����S��16��Ԫ�أ�Sԭ�ӻ��2�����ӱ�ΪS2-�������ӵĽṹʾ��ͼΪ�� ��
��
�ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��Ũ������ľ̿��Ӧ���ɶ�����̼�����������ˮ��
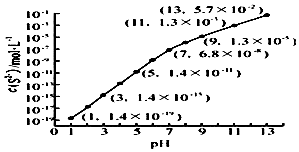
��2����pH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1��
�ڵ�Qc=Ksp��MnS��ʱ��ʼ�������ɴ���������ӵ�Ũ�ȣ����ͼ��ó���ʱ��pH��
��3������ƽ�ⳣ���ȽϿ�֪��HSO3-��H2CO3 ������NaHSO3��Һ��NaHCO3��Һ��Ӧ�����������ơ�������̼��ˮ��
��� �⣺��1����S��16��Ԫ�أ�Sԭ�ӻ��2�����ӱ�ΪS2-�������ӵĽṹʾ��ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��Ũ������ľ̿��Ӧ���ɶ�����̼�����������ˮ����Ӧ�ķ���ʽΪ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$2SO2��+CO2��+2H2O��
�ʴ�Ϊ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$2SO2��+CO2��+2H2O��
��2����pH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1������c��H2S��+c��HS-��=0.1-5.7��10-2=0.043mol/L���ʴ�Ϊ��0.043��
�ڵ�Qc=Ksp��MnS��ʱ��ʼ����������c��S2-��=$\frac{Ksp��MnS��}{c��M{n}^{2+}��}$=$\frac{2.8��1{0}^{-13}}{0.020}$=1.4��10-11mol/L�����ͼ��ó���ʱ��pH=5������pH=5ʱ�����ӿ�ʼ������
�ʴ�Ϊ��5��
��3������ƽ�ⳣ���ȽϿ�֪��HSO3-��H2CO3 ������NaHSO3��Һ��NaHCO3��Һ��Ӧ�����������ơ�������̼��ˮ����Ӧ�����ӷ���ʽΪ��2HSO3-+CO32-=2SO32-+CO2��+H2O��
�ʴ�Ϊ��2HSO3-+CO32-=2SO32-+CO2��+H2O��
���� ���⿼��Ԫ��ԭ�ӽṹʾ��ͼ����д���������ʵĻ�ѧ����ʽ��д���ε�ˮ��ƽ�⡢������ʵ���ƽ�⡢�����ܽ�ƽ���֪ʶ������Ũ�ȴ�С�Ƚϵ�Ӧ�ã���Ŀ�Ѷ��еȣ�


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuSO4 | B�� | CO2 | C�� | NaOH | D�� | H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҺpHֵ�Ӵ�С���Ǣۣ��ڣ��٣��� | |
| B�� | c��H2S�� �Ӵ�С�Ǣ٣��ܣ��ڣ��� | |
| C�� | ��H2S ��NaHS���Һ�У�2c��Na+���Tc��H2S��+c��HS-��+c��S2-�� | |
| D�� | ��NaHS��Һ�У�c��H+��+c��Na+���Tc��OH-��+c��HS-��+c��S2-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��8•12������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��أ�����狀��軯�ƣ�NaCN������ش��������⣺
��8•12������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��أ�����狀��軯�ƣ�NaCN������ش��������⣺ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
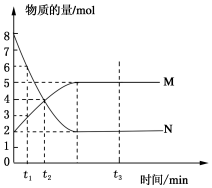 һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g��?bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g��?bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 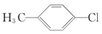 | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
 | 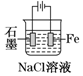 | 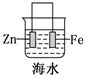 | 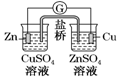 |
| ���϶��� | ��ⷨ���� | ������ | ͭпԭ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com