
| A. | 蛋白质都能与浓硝酸发生显色反应 | |
| B. | 糖类不都能发生水解反应 | |
| C. | 油脂都不能使溴的四氯化碳溶液退色 | |
| D. | 水是营养物质 |
分析 A、含苯环的蛋白质才能与浓硝酸发生显色反应;
B、糖类分为单糖、双糖和多糖;
C、油脂分为植物油和脂肪;
D、糖类、油脂、蛋白质、水、无机盐和脂肪是六大营养物质.
解答 解:A、含苯环的蛋白质才能与浓硝酸发生显色反应,故并不是所有的蛋白质均能发生显色反应,故A错误;
B、糖类分为单糖、双糖和多糖,双糖和多糖能发生水解,但单糖不能,故B正确;
C、油脂分为植物油和脂肪,植物油中含碳碳双键,故能是溴的四氯化碳溶液褪色,但是饱和的高级脂肪酸和甘油形成的酯类,故不能使溴的四氯化碳溶液褪色,故C错误;
D、糖类、油脂、蛋白质、水、无机盐和脂肪是六大营养物质,即水是营养物质之一,故D正确.
故选BD.
点评 本题考查了糖类、油脂和蛋白质的性质,难度不大,属于记忆性知识的考查,应加强基础的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | 物质的量表示含有一定数目粒子的集体 | |
| C. | 物质的量是国际单位制中的一个基本单位 | |
| D. | 摩尔是计量原子、分子或离子等微观粒子的“物质的量”的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 自然界中钠只能以化合物的形式存在 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用食品添加剂与提倡绿色食品相违背 | |
| B. | 含有食品添加剂的食品应该少食,以防中毒 | |
| C. | 没有加任何添加剂的天然食品是最安全的 | |
| D. | 食品添加剂在合理限量范围内不影响人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
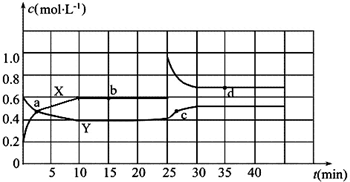
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com