
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量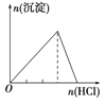
B.向 AlCl3 溶液中逐滴 滴加氨水至过量
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量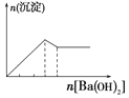
D.向澄清石灰水中缓缓 通入 CO2 至过量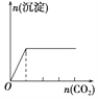
【答案】C
【解析】
A. NaAlO2溶液中滴加稀盐酸,有关反应为AlO2- + H+ + H2O = Al(OH)3 ↓和Al(OH)3 + 3H+ = Al3+ + 3H2O,逐渐产生沉淀,达到一定量后沉淀逐渐减少直至完全消失,图像应为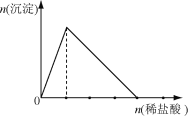 ,A错误;
,A错误;
B. 向 AlCl3 溶液中逐滴 滴加氨水至过量,沉淀不溶解,图像错误,B错误;
C. 向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量,根据反应式2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓可知,当加入1.5mol氢氧化钡时生成1.5mol硫酸钡和1mol氢氧化铝。根据反应式KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O可知,当加入2mol氢氧化钡时,生成的氢氧化铝又溶解生成偏铝酸钠,此时硫酸钡的沉淀达到最大值,因此图像可表示为,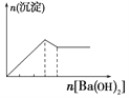 ,C正确;
,C正确;
D. 向澄清石灰水中缓缓 通入 CO2 至过量,会生成能溶于水的碳酸氢钙,沉淀会消失,D错误;
故答案选C。


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) 2Z(g)+2W(g)在2 L密闭容器中进行,5 min时Y减少了0.5 mol,0~5 min内此反应的平均速率为
A.v(X)=0.05 mol·L1·min1
B.v(Y)=0.10 mol·L1·min1
C.v(Z)=0.10 mol·L1·min1
D.v(W)=0.05 mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
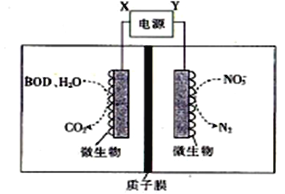
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是自来水表的常见安装方式。下列有关说法不正确的是

A. 该安装方式的水表更容易被腐蚀
B. 发生腐蚀过程中,电子从接头流向水表
C. 腐蚀时水表发生的电极反应为: 2H2O+O2+4e4OH
D. 腐蚀过程还涉及反应:4Fe(OH)2+2H2O+O24Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
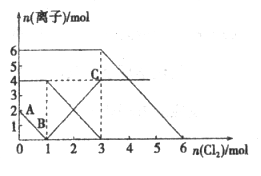
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 用惰性电极电解MgCl2 溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向氯化铝溶液中滴加少量Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
C. 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
D. FeCl3溶液与NaAlO2溶液混合:Fe3++ 3AlO2-=Fe(AlO2)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()
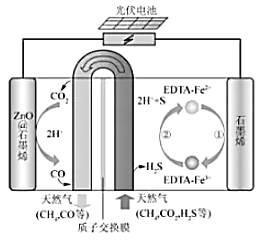
①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
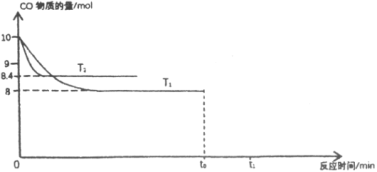
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com