
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
分析 化学式结构组成相似的,Ksp越小,溶解度越小;化学式结构组成不相似的,不能直接比较,要根据Ksp求出其浓度,再比较溶解度大小.
解答 解:由Ca(OH)2与Mg(OH)2化学式结构组成相似,而且Ca(OH)2的Ksp大于Mg(OH)2的Ksp,所以氢氧化镁的溶解度小;
c[Mg(OH)2]=c(Mg2+)=$\root{3}{\frac{1.2×1{0}^{-11}}{4}}$=$\root{3}{3}$××10-3mol/L,c(AgCl)=c(Ag+)=$\sqrt{1.56×1{0}^{-10}}$=$\sqrt{1.56}$×10-5mol/L,所以AgCl的溶解度比Mg(OH)2的溶解度小,故C正确,AB错误;
D、化学式结构组成不相似的,不能直接根据Ksp比较溶解度大小,故D错误;
故选C.
点评 本题考查了溶度积常数与溶解度的关系,侧重于计算的考查,题目难度中等,注意把握计算公式的应用.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气与11.2LNH3含有的原子数相同 | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
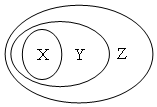 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 氯化钠 | 电解质 | 化合物 |
| C | 金属氧化物 | 碱性氧化物 | 氧化物 |
| D | 牛奶 | 胶体 | 分散系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微量元素缺少或者摄入过多,都可能导致患各种代谢疾病 | |
| B. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 | |
| C. | 人体缺钙,可以多喝硬水补钙 | |
| D. | 缺铁性贫血,可通过食用铁强化酱油预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com