
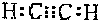 ��
��
���� ��1��ת����ϵ�����漰�ķ�ӦΪ��������ԭ��Ӧ������Ϊˮ��
������Ϊ��״���壬��Ϊ��ȼ�����壬������ڼȺ��м��Լ��ֺ��зǼ��Լ��������Ӧ��ʵ��������Ȳ�ķ�Ӧ��������Ȳ��
����������N��ClԪ����ɵĻ����������Ư���ԣ����������Ư���ԣ�����NCl3��
��2��ת����ϵ�����漰�ķ�ӦΪ������ԭ��Ӧ������Ϊˮ��
�����ͱ���ͬ����Ԫ����ɵĵ��ʣ�����ɼ�Ԫ��λ�ڵ������ڣ������Ӧ������ˮ�ķ�Ӧ��
�������Ͷ�������һ�������»�ԭCuO�������Ӧ��C��H2O�ķ�Ӧ��
����������N��OԪ����ɵ���̬���ʣ��ʺ���ɫ�������Ӧ��3NO2+H2O=2HNO3+NO���������ᷴӦ�����ɵ����嶡ΪNO�����ݵ�ʧ�����غ������Ԫ�صĻ��ϼۼ��������ʵ������ݴ���д��
��3���ٻ���ɫ����Ϊ�����������백����Ӧ���ɵ������Ȼ�泥�
�ڴ������Ĵ������̳��������μ�Ũ��ˮ�����ٲ������̣�˵����Ӧ������
��� �⣺��1��������Ϊ��״���壬��Ϊ��ȼ�����壬��ˮ��Ӧ���ɿ�ȼ�����壬���Լ���̼���ƣ�������Ȳ����Ȳ��̼ԭ��֮���γ�3�Թ��õ��Ӷԣ�̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�����Ȳ����ʽΪ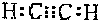 ��
��
�ʴ�Ϊ�� ��
��
����������N��ClԪ����ɵĻ�����������е��Ӳ�������ԭ�Ӱ뾶���Ӳ����ٵ�ԭ�Ӱ뾶С������ͼƬ֪������NCl3 ��NCl3 ��ˮ��Ӧ����ʽΪNCl3 +3H2O=NH3+3HClO�����������Ư���ԣ���NCl3 ��Ϊ+1�ۣ�
�ʴ�Ϊ��+1��
��2�������ͱ���ͬ����Ԫ����ɵĵ��ʣ�����ɼ�Ԫ��λ�ڵ������ڣ����ʼ�ˮ��Ӧ����ͬ����ı�������������ԭ��Ӧ�����Լ����ƣ��ƺ�ˮ��Ӧ�����������ơ���������Ӧ����ʽΪ2Na+2H2O=2Na++2OH-+H2����
�ʴ�Ϊ��2Na+2H2O=2Na++2OH-+H2����
�ڱ��Ͷ�������һ�������»�ԭCuO���ܺ�������ͭ��������������һ����̼��̼����ˮ��Ӧ�õ����Ͷ������Լ���̼��������̼��ˮ��Ӧ����������һ����̼����Ӧ����ʽΪ��C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
�ʴ�Ϊ��C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2 ��
����������N��OԪ����ɵ���̬���ʣ��ʺ���ɫ�����Լ��Ƕ�������������������ˮ��Ӧ���������һ������������ϡ���ᷴӦ����һ���������������ʵ���Ϊ$\frac{3.36g}{56g/mol}$=0.06mol��NO�����ʵ���Ϊ$\frac{1.12L}{22.4L/mol}$=0.05mol
�����ɵ�Fe2+Ϊxmol��Fe3+Ϊymol����
x+y=0.06
2x+3y=0.05��3
x=0.03mol��y=0.03mol
���Է�Ӧ����ʽΪ��6Fe+20HNO3=3Fe��NO3��2+3Fe��NO3��3+5NO+10H2O����Ӧ�����ӷ���ʽΪ��6 Fe+20OH++5 NO3-�T3 Fe2++3 Fe3++5 NO��+10 H2O��
�ʴ�Ϊ��6 Fe+20OH++5 NO3-�T3 Fe2++3 Fe3++5 NO��+10 H2O��
��3���ٻ���ɫ����Ϊ�����������백����Ӧ���ɵ������Ȼ�泥���Ӧ����ʽΪ��8NH3+3C12=N2+6NH4Cl��
�ʴ�Ϊ��8NH3+3C12=N2+6NH4Cl��
�ڴ������Ĵ������̳��������μ�Ũ��ˮ�����ٲ������̣�˵����Ӧ������
�ʴ�Ϊ���������Ĵ������̳��������μ�Ũ��ˮ�����ٲ������̣�
���� ���������ʵ��ƶ�Ϊ���忼����Ԫ�ػ���������ʣ�����ȷ�ƶ������ǽⱾ��Ĺؼ����ѵ����ж�NCl3��H2O��Ӧ�IJ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ��е�ˮ��Na�� | B�� | ���������е��Ҵ������ᣩ | ||
| C�� | ���������е����ᣨ����Na2CO3��Һ�� | D�� | �����еı��ӣ�NaOH��Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2 | B�� | NH3•H2O | C�� | HCl | D�� | AgNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢڢ� | B�� | �ۢ٢ܢ� | C�� | �ܢۢڢ� | D�� | �ܢۢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
��
 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ�� Br-��NO3-��Na+��SO32- | |
| B�� | ��ˮ�������C��H+��=1��10 -12 mol•L-1����Һ��K+��Ba2+��HCO3-��Cl- | |
| C�� | 0.1 mol•L-1FeCl3��Һ��K+��NH4+��NO3-��SO42- | |
| D�� | c��H+��/c��OH-��=1��10 -12����Һ��Ca2+��Fe3+��ClO-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
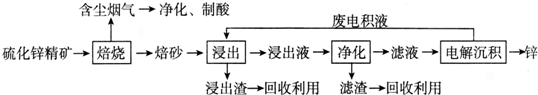
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com