
| A. | 加入Al能放出H2的溶液中:ClO-、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、NH${\;}_{4}^{+}$ | |
| B. | pH=2的溶液中:Fe2+、Na+、Mg2+、NO${\;}_{3}^{-}$ | |
| C. | 能使KSCN溶液变红的溶液中:Na+、I-、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | |
| D. | 由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- |
分析 A.加入Al能放出H2的溶液可能呈酸性或碱性;
B.pH=2的溶液呈酸性;
C.能使KSCN溶液变红的溶液含有Fe3+;
D.由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液可能呈酸性或碱性.
解答 解:A.加入Al能放出H2的溶液可能呈酸性或碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故A错误;
B.pH=2的溶液呈酸性,酸性条件下Fe2+、NO3-发生氧化还原反应,故B错误;
C.能使KSCN溶液变红的溶液含有Fe3+,与I-发生氧化还原反应,与HCO3-发生互促水解反应,故C错误;
D.由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液可能呈酸性或碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高考高频考点,侧重氧化还原反应的离子共存问题的考查,注意信息的抽取和应用,选项C为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | |
| B. | 分别加稀硫酸煮沸,再加足量NaOH溶液调至碱性,加银氨溶液加热观察有无银镜 | |
| C. | 分别加热水溶解,观察溶解性 | |
| D. | 放在嘴里咀嚼,有无甜味产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
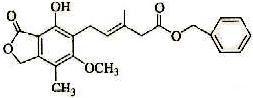
| A. | 一定条件下,既可以与Br2发生加成反应,又可以与Br2发生取代反应 | |
| B. | 1 mol该化合物最多可以与3 molNaOH反应 | |
| C. | 既可以催化加氢,又可以在稀硫酸存在下水解得2种有机物 | |
| D. | 可以与Na2CO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
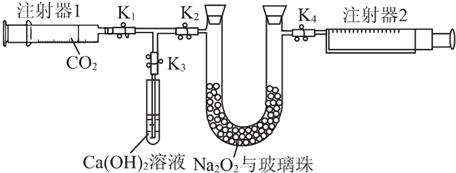
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
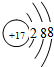 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
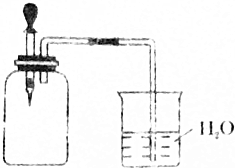 如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.
如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

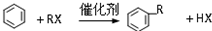 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;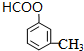 、
、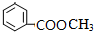 ;
;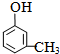 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com