



科目:高中化学 来源: 题型:
| A、11.2L氯气含有的分子数为0.5NA |
| B、32g氧气中所含有的氧原子数为2NA |
| C、2.4g镁变成镁离子,转移的电子数为0.1NA |
| D、1L 0.3mol/L K2SO4溶液中含有的K+数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
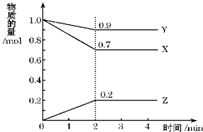 (1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:
(1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:查看答案和解析>>
科目:高中化学 来源: 题型:
 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
 在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:
在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
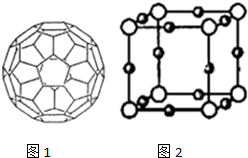 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:H2O>HBr>HCl |
| B、水溶性:HCl>H2S>SO2 |
| C、沸点:乙烷>戊烷>丁烷 |
| D、热稳定性:HCl>H2S>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com