
(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
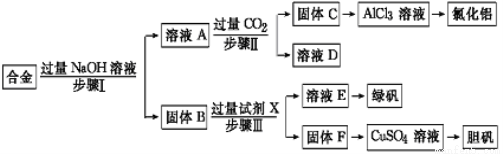
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
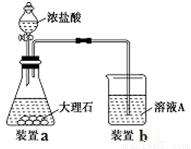
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
(1)2Al+2OH—+2H2O=2AlO2-+3H2↑(2分)(2)稀硫酸或H2SO4(2分) 过滤(2分)
(3)在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶(2分)
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O(2分)
途径②最佳,理由是原料利用率高,环境污染小(2分)
【解析】
试题分析:(1)在合金中含有铝、铁和铜,向其中加入过量的NaOH溶液,其中的Al会发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,步骤Ⅰ反应的离子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,(2)而Fe、Cu不能发生反应,过滤出来;在固体B中含有Fe、Cu,向其中加入过量的硫酸,由于Fe的活动性在金属活动性顺序表H前边,而Cu位于H的后边,所以Fe发生反应产生FeSO4,而Cu仍然是固体,将二者通过过滤分离开来,滤液蒸发浓缩、冷却结晶,就得到绿矾;再向固体Cu中加入浓硫酸并加热,发生氧化还原反应产生CuSO4,将该溶液蒸发浓缩冷却结晶,就得到胆矾。向含有NaAlO2的滤液中通入过量的CO2气体,会产生Al(OH)3沉淀和NaHCO3溶液,将沉淀和溶液通过过滤分离开,将沉淀沉淀后用适量的盐酸溶解得到AlCl3溶液,最后在HCl的气氛中加热蒸发水分得到固体AlCl3。所以X是稀硫酸;步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是过滤;(3)由于盐酸有挥发性,在制取的CO2气体中含有杂质HCl,所以直接进行步骤Ⅱ时制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,应该先将杂质HCl除去,可采取的改进措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶;(4)在途径①中,Cu与稀硫酸、稀硝酸的混合物反应的离子方程式是:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;在途径①中会产生有毒气体NO,不环保;在途径②中,Cu与氧气加热产生CuO,再用酸溶解,得到硫酸铜,不仅无污染,而且原料的利用率也高;在途径③中发生反应:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O,会产生大气污染物SO2,而且原料的利用率也降低,因此三种方法比较,最好的是方法②。
CuSO4+SO2↑+2H2O,会产生大气污染物SO2,而且原料的利用率也降低,因此三种方法比较,最好的是方法②。
考点:考查物质的综合利用的知识,主要包括方案的设计、物质的选择、方法的比较、方程式的书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:实验题
(15分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
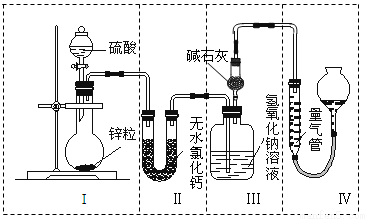
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为 ;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是 ;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)= ;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mloI·L-1H2SO4溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、HCO3-
C.0.l mol·L-lNaClO溶液:Fe2+、K+、I一、Cl-
D.c(OH-)/c(H+)=lxl014的溶液:Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
(12分)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
A.减压 B.增加NH3的浓度 C.升温 D.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.K2FeO4具有还原性,可用于自来水的杀菌消毒
C.浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸
D.SO2具有漂白性,能使紫色KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:填空题
(12分)I.硝酸铜在1000℃时分【解析】
Cu(NO3)2=Cu+2NO2↑+O2,用试管收集一试管气体并倒立于盛水的水槽中,观察到的现象是 ,若溶质不扩散,试管内溶液中溶质的物质的量浓度是 (假设在标准状况下)。
II.工业上生产硝酸铜晶体的流程图如下:
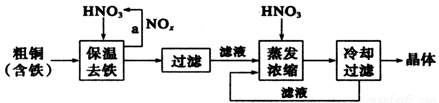
①若保温去铁反应生成气体是NO时,则离子方程式是 。
②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是 (结合离子方程式说明)。
③如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。

a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·3H2O晶体
④某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:2H2O OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
[物质结构与性质]磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3·BCl3制得。
(1)锌离子基态时核外电子排布式为 。
(2)PH3中磷原子的杂化轨道类型为 , BCl3空间形状为 (用文字描述)。
BCl3空间形状为 (用文字描述)。
(3)PCl3能够与配合物Ni(CO)4 发生配体置换反应:Ni(CO)4 +4PCl3 = Ni(PCl3)4 +4CO。
①与CO互为等电子体且带1个单位负电荷的阴离子化学式为 。
②1molNi(PCl3)4中含 键数目为 。
键数目为 。
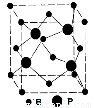
(4)立方BP的晶胞结构如图所示,晶胞中含B原子数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com