
| A. | ( 2b+2c-a)kJ•mol-1 | B. | (a-2b-2c) kJ•mol-1 | ||
| C. | (b+c-a) kJ•mol-1 | D. | (a-2b-c) kJ•mol-1 |
分析 已知乙醇、石墨和氢气的燃烧热分别为a、b、c;
则(1)C2H5OH(l)+3O2(g)-→2CO2(g)+3H2O(l)△H1=-akJ•mol-1
(2)C(石墨)+O2(g)-→CO2(g)△H2=-bkJ•mol-1
(3)H2(g)+1/2O2(g)-→H2O(l)△H3=-ckJ•mol-1
所以2C(石墨)+2H2(g)+H2O(l)=C2H5OH(l)可以根据盖斯定律2×(2)+2×(3)-(1)计算得到.
解答 解:已知乙醇、石墨和氢气的燃烧热分别为a、b、c;
则(1)C2H5OH(l)+3O2(g)-→2CO2(g)+3H2O(l)△H1=-akJ•mol-1
(2)C(石墨)+O2(g)-→CO2(g)△H2=-bkJ•mol-1
(3)H2(g)+1/2O2(g)-→H2O(l)△H3=-ckJ•mol-1
所以1mol乙醇的热化学方程式为:2C(石墨)+2H2(g)+H2O(l)=C2H5OH(l)可以根据以上反应经过2×(2)+2×(3)-(1)处理得到,所以△H=(a-2b-2c)kJ•mol-1.
故选:B.
点评 本题考查学生盖斯定律的应用、熵变的概念和计算以及吉布斯自由能的计算等知识,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:解答题

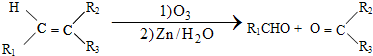
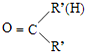 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$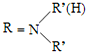 +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
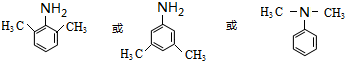 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向Ba(OH)2溶液中加稀H2SO4 | B. | 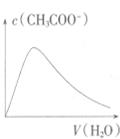 向冰醋酸中加蒸馏水 | ||
| C. |  向稀NaOH溶液中加稀盐酸 | D. | 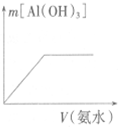 向AlCl3溶液中加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
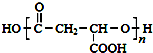 ,合成M的流程图如下:
,合成M的流程图如下: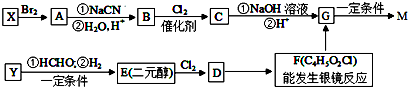
 ,
, .
.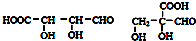 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇 | B. | 乙二醇 | C. | 异丙醇 | D. | 甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com