
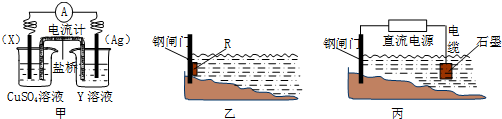
分析 (1)含有盐桥的原电池中,电极材料和相对应电解质溶液中阳离子元素相同,原电池放电时,电子从负极沿导线流向正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,盐桥中的阳离子移向正极,阴离子移向负极;
(2)①生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应,正极上是氧气得电子的还原反应;
②在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(3)①依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应;
②放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2;
③放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应.
解答 解:(1)①含有盐桥的原电池中,电极材料和相对应电解质溶液中阳离子元素相同,所以X为Cu,Y为AgNO3溶液,故答案为:Cu;AgNO3溶液;
②盐桥中的阳离子移向正极,阴离子移向负极,Cl-移向负极向CuSO4溶液一端扩散,故答案为:Cl-;
(2)①炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈,在铁的吸氧腐蚀中,负极上铁失电子发生氧化反应,Fe=Fe2+2e-,正极上是氧气得电子的还原反应,O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钾钙钠都不能做电极材料,故答案为:C;
③电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为:负;
(3)①根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe被氧化发生氧化反应,正极为NiO2,被还原发生还原反应,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,
故答案为:A;
②放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,所以pH增大,故答案为:增大;
③放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应,电极反应式为:Ni(OH)2+2OH--2e-=NiO2+2H2O,故答案为:Ni(OH)2+2OH--2e-=NiO2+2H2O.
点评 本题考查学生盐桥原电池的工作原理、金属的腐蚀和防护方面的知识,铅蓄电池相关知识,注意知识的迁移和应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | OH- | C. | Ag+ | D. | CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56gN2和CO的混合气体中含有的原子总数目为2NA | |
| B. | 标准状况下,11.2L乙醇中含有的分子数目为0.5NA | |
| C. | 1L1mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 2.7gAl粉在足量的Cl2中完全燃烧转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 常温常压下,16克氧气含原子数为2NA | |
| C. | 0.1 mol•L-1的 FeCl3溶液Cl-的数目为0.3NA | |
| D. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g/mol | B. | 32g/mol | C. | 64g/mol | D. | 128g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com