
Fe (OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两类物质。请你判断FeCl3溶液、Fe (OH)3胶体共同具备的性质是
A.都呈透明的红褐色
B.都比较稳定,密封保存一段时间都不会产生沉淀
C.分散质颗粒直径相同
D.当有光线透过时,都能产生丁达尔效应
科目:高中化学 来源:2017届湖北省沙市高三上学期第二次考试化学试卷(解析版) 题型:选择题
下图所示的实验装置不能完成实验目的是
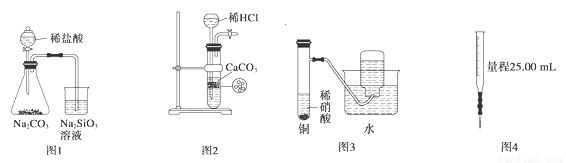
A.图1为证明非金属性强弱:Cl>C>Si B.图2为制备少量CO2并控制反应
C.图3为制备并收集少量NO气体 D.图4量取0.10 mol·L-1 KOH溶液20.00 mL
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三第一次诊断性考试化学试卷(解析版) 题型:选择题
设NA为值。下列说法正确的是
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA
D.标准状况下,2.24 L已烷含有分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第一次月考化学试卷(解析版) 题型:选择题
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
则下列有关说法不正确的是
A.氧化性:Cr2O72->Fe3+>SO2
B.标准状况下,若有6.72 L SO2参加反应,则最终消耗0.2 mol K2Cr2O7
C.反应②中,每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D.由上述反应原理推断:K2Cr2O7能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第一次月考化学试卷(解析版) 题型:选择题
在一定条件下,使CO和O2的混合气体26g充分反应,所得气体混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比为
A.9 ∶4 B.1 ∶1 C.7 ∶6 D.6 ∶7
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:填空题
能源和环境保护是世界各国关注的热点话题。请回答下列问题:
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。

Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g) +3H2 (g) 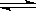 CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
(1)0~10 min内v(H2)=_____________,
A点含义是_____________。
该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T,CH3OH的浓度以每分钟0.030 mol/L逐渐增大,经5 min又达到新平衡。T____________(填“>”、“<”或“=”)500℃,判断理由是___________________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
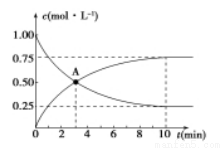
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。
(1)石墨1为___________(填“正极”或“负极”);
正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
影响化学反应速率的因素有:浓度、压强、温度、催化剂等。下列有关说法不正确的是
A.改变压强不一定能改变有气体参与反应的速率
B.增大浓度能加快化学反应速率,原因是增大浓度增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了单位体积内活化分子总数
D.催化剂能加快化学反应速率主要原因是降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:填空题
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)


(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上9月综合能力测试化学试卷(解析版) 题型:选择题
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A、1:1 B、1:4 C、4:1 D、1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com