
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.⑤ D.④⑥
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:计算题
(5分)将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g,求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:填空题
(18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
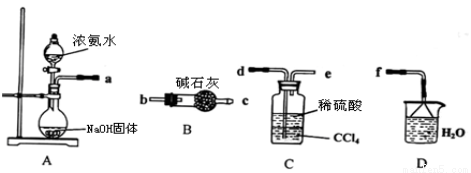
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因: 。
(3)将装置C中两种液体分离开的操作名称是 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
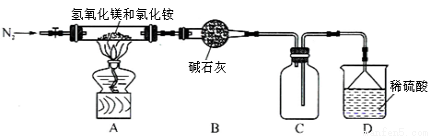
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是 。
(3)由MgCl2溶液得到MgCl2·6H2O晶体,操作为 、 、
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: 。
②由MgCl2·6H2O加热制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.加水稀释C(OH?)/C(H+)增大的溶液:K+、Na+、SO42-、[Al(OH)4]-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)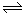 Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
将1mol NaHCO3和1mol Na2O2固体混合,在加热的条件理使其充分反应,则最后所得固体为
 A.1mol Na2CO3和1mol NaOH B.lmol Na2CO3和2molNaOH
A.1mol Na2CO3和1mol NaOH B.lmol Na2CO3和2molNaOH
C.2mol Na2CO3和2molNaOH D.2mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
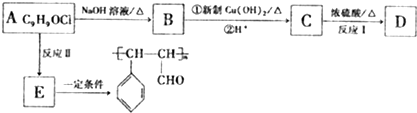
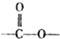 结构的芳香族化介物的同分异构体有
结构的芳香族化介物的同分异构体有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com