
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
分析 A.该溶液呈酸性或碱性,铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应;
B.四种离子之间不反应,为澄清透明溶液;
C.铁离子与碘离子、硫氰根离子反应;
D.该溶液呈酸性,次氯酸根离子与氢离子反应.
解答 解:A.水电离出的c(H+)=10-13mol•L溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Mg2+、Cu2+、SO42-、Cl-之间不反应,为澄清透明溶液中,在溶液中能够大量共存,故B正确;
C.Fe3+与I-、SCN-反应,在溶液中不能大量共存,故C错误;
D.该溶液呈酸性,溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,在原子不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
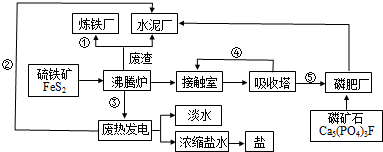
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
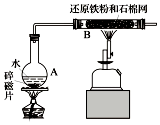 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/LNaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 | |
| B. | 实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 | |
| C. | 少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaOH溶液 | |
| D. | 使用分液漏斗萃取碘水中的碘,振荡过程中要适时打开活塞进行“放气” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸,实质是电解水,溶液pH不变 | |
| B. | 电解氢氧化钠稀溶液,溶液浓度增大,pH变小 | |
| C. | 电解氯化钠溶液,溶液浓度减小,pH不变 | |
| D. | 电解硫酸铜溶液,要消耗OH-溶液,pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
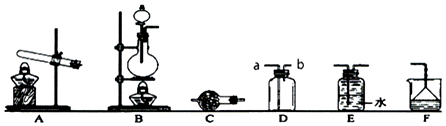
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;A与C组成的化合物为MgS(用具体元素符号表示).
;A与C组成的化合物为MgS(用具体元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
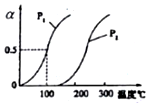 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com