
【题目】实验室可以用苯乙酮间接电氧化法合成苯甲酸,原理如图所示,下列说法正确的是( )
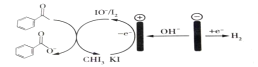
A.这个装置是将化学能转化为电能
B.阴极反应是2H++2e═H2↑
C.阳极I-失去电子后的产物与OH-反应的离子方程式为I2+2OH-=I-+IO-+H2O
D.此装置需要定期向电解质溶液中添加KI溶液
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH= N2H4·H2O +NaCl+Na2CO3
①制取次氯酸钠和氢氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为____。
②制备水合肼时,应将__________滴到__________中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
③尿素的电子式为__________________
(2)碘化钠的制备:采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
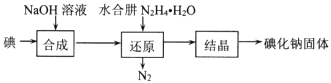
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为 ___。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00 g样品并溶解,在500 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c. 用0.2000 mol·L1的 Na2S2O3标 准 溶 液 滴 定 至 终 点(反 应 方 程 式2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00 mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料合成中间体,其合成路线如图:
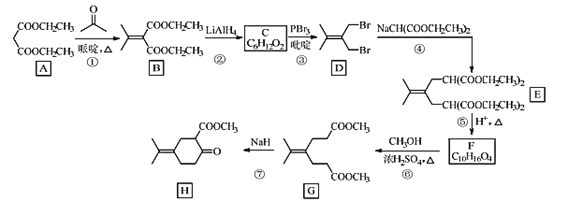
回答下列问题:
(1)A的化学名称是___。
(2)A到B的反应方程式是___。
(3)C的结构简式是___。
(4)④的反应类型是___。
(5)H中的含氧官能团的名称是___。
(6)X是F的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1。写出两种符合上述条件的X的结构简式___。
(7)设计由苯甲醇和 制备
制备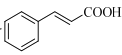 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把![]() 气体X和
气体X和![]() 气体Y混合于2L容器中,发生反应:
气体Y混合于2L容器中,发生反应:![]()
![]()
![]() ,5分钟末已生成
,5分钟末已生成![]() ,若测知以Z浓度变化来表示的平均速率为
,若测知以Z浓度变化来表示的平均速率为![]() ,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
A. 20% B. 25% C. 33% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol,③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol,④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol,回答下列问题:
(1)上述反应中属于放热反应的是_____(填写序号)。
(2)H2的燃烧热为_____。
(3)燃烧10g H2生成液态水,放出的热量为______。
(4)H2O(g)=H2O(l)△H=________。
(5)C(s)的燃烧热的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂硫胺(Cinanserin)是上世纪70年代用于抗精神分裂症的药物,对冠状病毒3CL水解酶具有抑制作用,下图是其合成路线图。

已知以下信息:
①A为常见的烃,它对H2的相对密度为39
②2RCOOH RCH2OH
RCH2OH
③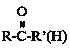 +HCN
+HCN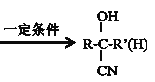
回答下列问题:
(1)A的名称__________;B的结构简式___________;肉桂硫胺中含氧官能团的名称__________。
(2)步骤①的反应方程式________________,其反应类型为_________。
(3)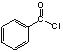 中共平面的原子最多________个。
中共平面的原子最多________个。
(4)M是C的同分异构体,符合下列条件的M有_______种。
①属于芳香族化合物。②能发生银镜反应。
(5)参照题干,写出由![]() 制备
制备![]() 的流程图。_______。
的流程图。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所做出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,浓度均为1mol·L1的CH3COOH和HCl分别做导电性实验,CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向浓度均为0.1 mol·L1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 分别向pH=3的盐酸和草酸溶液中加入足量锌粒,一段时间后草酸反应速率更快 | 草酸是二元酸 |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH为10;0.1 molL-1 NaHSO3溶液pH为5 | HSO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com