
| A. | 当a≤100时,发生的离子反应为:OH-+H+=H2O | |
| B. | 当a≥300时,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑ | |
| C. | 当100<a<200时,反应后的溶液中CO32-与HCO3-的物质的量之比为(a×10-4-0.01):(0.02-a×10-4) | |
| D. | 当a=200时,发生的离子反应为:OH-+2H++CO32-=H2O+HCO3- |
分析 当a≤100时,稀盐酸不足,NaOH优先反应,发生的离子反应为:OH-+H+=H2O;当a=200时,NaOH完全反应,剩余的盐酸恰好与碳酸钠反应生成碳酸钠,发生的离子反应为:OH-+2H++CO32-=H2O+HCO3-;当a≥300时,稀盐酸过量,氢氧化钠和碳酸钠完全反应,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑,据此进行解答.
解答 解:A.当a≤100时稀盐酸不足,NaOH优先反应生成氯化钠和水,反应的离子反应为:OH-+H+=H2O,故A正确;
B.当a≥300时NaOH过量,反应生成氯化钠、二氧化碳气体和水,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑,故B正确;
C.当100<a<200时,氢氧化钠稍过量,反应生成氯化钠、碳酸氢钠,HCl的物质的量为:0.1mol/L×a×10-3L=a×10-4mol,NaOH消耗HCl的物质的量为0.01mol,与碳酸钠反应的HCl的物质的量为:a×10-4mol-0.01mol=(a×10-4-0.01)mol,则反应后碳酸氢根离子的物质的量为(a×10-4-0.01)mol,剩余碳酸根离子的物质的量为:0.01mol-(a×10-4-0.01)mol=(0.02-a×10-4)mol,所以反应后的溶液中CO32-与HCO3-的物质的量之比为(0.02-a×10-4):(a×10-4-0.01),故C错误;
D.当a=200时氢氧化钠完全反应,碳酸钠恰好转化成碳酸氢钠,反应的离子反应为:OH-+2H++CO32-=H2O+HCO3-,故D正确;
故选C.
点评 本题考查了离子方程式的计算与书写,题目难度中等,明确发生反应的实质为解答关键,注意根据反应物过量情况正确判断生成物,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
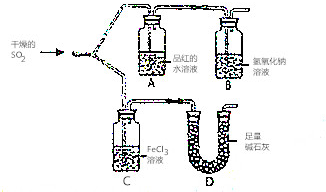 如图装置进行SO2气体性质实验
如图装置进行SO2气体性质实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粘有油脂的试管可以用热的纯碱溶液洗涤 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇氧化得到 | |
| C. | 煤的气化、液化只发生物理变化 | |
| D. | 天然气作为化工原料主要用于合成氨和合成甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气 二氧化碳 氢氧化钠 | B. | 氯化钠 过氧化钠 氯化铵 | ||
| C. | 氯化钠 过氧化氢 氯化铵 | D. | 氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
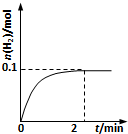 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com