
已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
| A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.四种铈的核素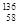 Ce、 Ce、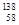 Ce、 Ce、 Ce、 Ce、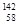 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
科目:高中化学 来源: 题型:单选题
下列应用不涉及氧化还原反应的是
| A.实验室用NH4Cl 和Ca(OH)2制备NH3 |
| B.工业上电解熔融状态Al2O3制备Al |
| C.工业上利用合成氨实现人工固氮 |
| D.Na2O2用作呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:
①向KMnO4晶体中滴加浓盐酸,产生某黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是( )
| A.①中产生气体的电子式是Cl?Cl |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验②中FeCl2被氧化 |
| D.实验③发生的是同主族元素单质间的置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O72—+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
| A.10 | B.12 | C.14 | D.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)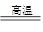 2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
下列说法不正确的是( )
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g)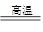 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法不正确的是( )
| A.N4和N2互为同素异形体 |
| B.14N与14C互为同位素 |
| C.N4H4(SO4)2不能与草木灰混合使用 |
| D.8NH3+4C5OH=N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )。
| A.反应后溶液中c(NO3-)=0.85 mol·L-1 |
| B.反应后的溶液最多还能溶解1.82 g Fe |
| C.反应前HNO3溶液的浓度为1.0 mol·L-1 |
| D.1.12 L气体是NO、NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是( )
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是(双选 ( )。
| A.在该反应中碘酸钠作氧化剂 |
| B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 |
| C.反应中生成1 mol Na2H3IO6转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com